Bài viết Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm từ đó biết cách làm bài tập về tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm.
Nội dung bài viết
Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm hay nhất
Với bài toán khi cho H2S tác dụng với dung dịch kiềm thì chúng ta xử lý thế nào? Làm thế nào để xác định trong dung dịch sau phản ứng có muối gì? Có cách nào tính nhanh bài toán này không? Vậy thì các em không thể bỏ qua bài viết dưới đây.
1. Công thức tính nhanh
TH1 : Khí H2S tác dụng dung dịch kiềm chỉ sinh ra muối
nOH- = nHS- = nH2S
TH2: Khí H2S tác dụng dung dịch kiềm chỉ sinh ra muối
nOH- = 2nS2- = 2nH2S
TH3: : Khí H2S tác dụng dung dịch kiềm sinh ra hỗn hợp muối HS- và S2-
nOH-= nH2S + nS2- = 2nH2S - nHS- = nHS- + 2nS2-
2. Bạn nên biết
Khi cho khí H2S tác dụng dung dịch NaOH hoặc KOH
H2S + NaOH →NaHS + H2O (1);
H2S + 2NaOH →Na2S + 2H2O (2)
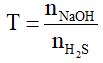
T ≤ 1 : tạo muối NaHS phản ứng (1) và H2Sdư
1 < T < 2 : tạo 2 muối NaHSvà Na2S : phản ứng (1) và (2)
T > 2 : tạo muối Na2S phản ứng (2) và NaOH dư
3. Mở rộng
Khi cho a mol H2S vào b mol Ba(OH)2 thu được dung dịch A
H2S + Ba(OH)2 -> BaS + 2 H2O (1)
2 H2S + Ba(OH)2 -> Ba(HS)2 + 2H2O (2)
Khi a < b, chỉ xảy ra phương trình 1, A chứa BaS và Ba(OH)2 dư
Khi a = b, chỉ xảy ra phương trình 1, A chứa BaS
Khi 2b > a, xảy ra phương trình (1)(2), A chứa BaS và Ba(HS)2
Khi 2b = a, chỉ xảy ra phương trình 2, A chứa Ba(HS)2
Khi 2b < a, chỉ xảy ra phương trình 2, A chứa Ba(HS)2
4. Bài tập minh họa
Câu 1: Hấp thụ hoàn toàn 4,48 lít khí H2S (đkc) vào 100ml dung dịch KOH 1,5M. Tính khối lượng muối thu được sau phản ứng?
A. 9,8 gam
B. 10,2 gam
C. 10,8 gam
D. 11,2 gam
Hướng dẫn
nH2S = 0,2 mol
nKOH = 0,1.1,5 =0,15 mol
Vì 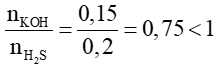 nên muối gồm KHS ; H2S dư
nên muối gồm KHS ; H2S dư
PTHH :
KOH + H2S -> KHS + H2O
-> nKHS = nKOH = 0,15mol
-> nKHS = 0,15.72 =10,8 gam
Đáp án C
Câu 2: Dẫn 3,36 lít khí H2S (đktc) vào 250 ml dung dịch KOH 2M, sau khi phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được m gam chất rắn khan. Giá trị của m là:
A. 16,5 gam.
B. 27,5 gam.
C. 14,6 gam.
D. 27,7gam.
Hướng dẫn
nH2S =0,15 mol ; nKOH = 0,5 mol
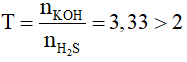
-> Chỉ tạo muối K2S
Phương trình hóa học:
H2S + 2KOH -> K2S + H2O
Dung dịch X gồm K2S và KOH dư
Chất rắn khan gồm K2S và KOH dư
nK2S = nH2S = 0,15 mol ; nKOHdu = 2nH2S = 0,3 mol
-> nKOHdu = 0,5-0,3 =0,2 mol
-> mcr = mK2S + mKOHdu = 0,15.110 + 0,2.56 = 27,7 gam
Đáp án D
Câu 3: Hấp thụ hoàn toàn V lít khí H2S (đktc) vào 200 ml dung dịch NaOH 1,25M thu được dung dịch X có chứa 12,3 gam hỗn hợp muối. Giá trị của V là
A. 4,48 lít.
B. 5,60 lít.
C. 3,36 lít.
D. 4,032 lít.
Hướng dẫn
Dung dịch X chứa hỗn hợp muối gồm NaHS (x mol) và Na2S (y mol)
mmuối = 56x+78y = 12,3 (1)
Bảo toàn nguyên tố Na:
nNaOH = nNaHS + 2. nNa2S
0,2. 1,25 = x+ 2y (2)
Từ (1) và (2) -> 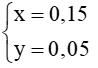
Bảo toàn nguyên tố S:
nH2S = nNaHS + nNa2S = 0,15 + 0,05 = 0,2 mol
-> VH2S = 0,2.22,4 = 4,48 lit
Đáp án A
Xem thêm tổng hợp các công thức Hóa học đầy đủ, chi tiết khác:
Tổng hợp công thức Hóa học lớp 8, 9 đầy đủ
Tổng hợp công thức Hóa học lớp 11 đầy đủ
Tổng hợp Công thức Hóa học lớp 12 đầy đủ
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.