Với Công thức tính hiệu suất phản ứng este hóa Hoá học lớp 12 chi tiết nhất giúp học sinh dễ dàng nhớ toàn bộ các công thức tính hiệu suất phản ứng este hóa từ đó biết cách làm bài tập Hoá học 12. Mời các bạn đón xem:
Nội dung bài viết
Công thức tính hiệu suất phản ứng este hóa hay nhất - Hoá học lớp 12
Phản ứng este hóa là phản ứng thuận nghịch (xảy ra không hoàn toàn) nên thường đi kèm với hiệu suất phản ứng. Cách tính hiệu suất phản ứng este hóa như thế nào? Bài viết dưới đây sẽ giúp các em học tốt dạng bài này.
1. Công thức tính hiệu suất phản ứng este hóa
Phương trình phản ứng điều chế este đơn chức từ axit cacboxylic đơn chức và ancol đơn chức có dạng:
Trong đó:
R là gốc hiđrocacbon,
R’ là gốc hiđrocacbon, R’ ≠ H
Theo phương trình:
- Tính hiệu suất theo chất phản ứng (tính theo chất có khả năng phản ứng hết)
hoặc
- Tính hiệu suất theo chất sản phẩm:
hoặc
- Áp dụng định luật bảo toàn khối lượng:
m axit p/ư + mancol p/ư = meste + m
Ví dụ: Đun 12 gam axit axetic với 13,8 gam etanol (có H2SO4 đặc làm xúc tác) đến khi phản ứng đạt tới trạng thái cân bằng, thu được 11 gam este. Hiệu suất của phản ứng este hóa là
A. 50%
B. 62,5%
C. 55%
D. 75%
Hướng dẫn giải
;
CH3COOH + C2H5OH CH3COOC2H5 + H2O
→ axit hết, hiệu suất phản ứng tính theo axit
→
→ Đáp án B.
2. Bạn nên biết
Nếu đề bài cho hiệu suất (H%) yêu cầu tính m, V,...
Bước 1: Tính m, V,... (theo phương trình).
Bước 2: Áp dụng quy tắc phải nhân – trái chia
+ Nếu m, V của sản phẩm (bên phải) thì nhân kết quả ở bước 1 với hiệu suất.
+ Nếu m, V,... của chất phản ứng (bến trái) thì chia kết quả ở bước 1 cho hiệu suất.
3. Kiến thức mở rộng
Điều chế este đa chức
Trong đó:
R là gốc hiđrocacbon,
R’ là gốc hiđrocacbon, R’ ≠ H
n, m lần lượt là số chức axit, ancol.
Xét tỉ lệ:
+ Nếu → axit dư, ancol có khả năng phản ứng hết.
+ Nếu → axit có khả năng phản ứng hết, ancol dư.
+ Nếu → cả hai chất đều phản ứng vừa đủ.
Chú ý:
- Tính theo phương trình hóa học phải tính theo chất có khả năng phản ứng hết.
- Phản ứng este hóa là phản ứng thuận nghịch (phản ứng không hoàn toàn).
4. Bài tập minh họa
Câu 1: Cho ancol etylic tác dụng với axit axetic thì thu được 22,0 gam este, H = 25%. Khối lượng ancol phản ứng là
A. 26,0 gam.
B. 46,0 gam.
C. 92,0 gam.
D. 11,5 gam.
Hướng dẫn giải
→ Đáp án B
Câu 2: Cho 0,1 mol glixerol (C3H5(OH)3) phản ứng với 0,15 mol axit acrylic (CH2 = CHCOOH) có H2SO4 đặc với hiệu suất là 60% thu được m gam este X. Giá trị của m là:
A. 7,62g
B. 15,24g
C. 21,167g
D. 9,62g
Hướng dẫn giải
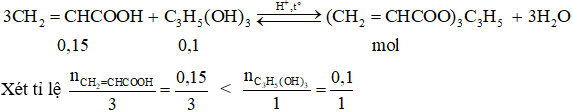
→ axit có khả năng hết.
Theo phương trình
n este lý thuyết = n axit = 0,05 mol
→ n este thực tế = 0,6.0,05 = 0,03 mol
→ m este thực tế= 254.0,03 = 7,62 gam
→ Đáp án A
Xem thêm tổng hợp các công thức Hóa học đầy đủ, chi tiết khác:
Tổng hợp công thức Hóa học lớp 10 đầy đủ
Tổng hợp công thức Hóa học lớp 11 đầy đủ
Công thức oxit cao nhất của các nguyên tố (phổ biến)
Công thức hidroxit cao nhất của các nguyên tố (phổ biến)
Công thức hợp chất khí với hidro của các nguyên tố (phổ biến)
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.