Với Công thức tính nhanh số mol H+ khi cho từ từ axit vào muối AlO2 (muối aluminat) Hoá học lớp 12 chi tiết nhất giúp học sinh dễ dàng nhớ toàn bộ các công thức tính nhanh số mol H+ khi cho từ từ axit vào muối AlO2 (muối aluminat) từ đó biết cách làm bài tập Hoá học 12. Mời các bạn đón xem:
Nội dung bài viết
Công thức tính nhanh số mol H+ khi cho từ từ axit vào muối AlO2 (muối aluminat) hay nhất – Hoá học lớp 12
Một trong những bài toán hay và khó về hợp chất của nhôm đó là cho từ từ dung dịch axit vào dung dịch muối aluminat. Khi gặp bài toán này, nhiều bạn thường lúng túng khi viết phương trình và tính toán. Bài viết dưới đây, sẽ giúp các bạn làm chủ lý thuyết và nắm vững cách giải nhanh bài tập dạng này. Các bạn đọc hãy tham khảo ngay và luôn.
1. Công thức tính nhanh số mol khi cho từ từ axit vào muối (muối aluminat)
Khi cho từ từ H+ vào dung dịch chứa muối AlO2– (hoặc [Al(OH)4]– ).
- Phương trình hóa học:
AlO2– + H+ + H2O →Al(OH)3↓(1)
Khi H+ dư:
Al(OH)3 + 3H+ → Al3+ + 3H2O (2)
- Hiện tượng: Khi cho từ từ H+ vào dung dịch chứa muối AlO2– , ban đầu xuất hiện kết tủa, khi cho dư H+ thì kết tủa tan dần.
- Khi đó tùy theo tỉ lệ số mol H+: số mol AlO2– mà có kết tủa hoặc không có kết tủa hoặc vừa có kết tủa vừa có muối tan.
+ Nếu nH+nAlO−2≤1→ Chỉ xảy ra phản ứng (1) → Thu được kết tủa Al(OH)3.
+ Nếu 1<nH+nAlO−2<4→ Xảy ra phản ứng (1) hoàn toàn, phản ứng (2) xảy ra 1 phần → Kết tủa cực đại bị hòa tan 1 phần.
+ Nếu nH+nAlO−2≥4→ Phản ứng (1) và (2) xảy ra hoàn toàn → Không thu được kết tủa.
- Công thức giải nhanh:
+ Chỉ xảy ra phản ứng (1): nH+=n↓
+ Xảy ra phản ứng (1) và (2): nH+=4nAl3+−3n↓
2. Bạn nên biết
- Sục từ từ khí CO2 vào dung dịch muối aluminat đến dư thì tạo kết tủa Al(OH)3.
- Phương trình hóa học:
CO2 + AlO2– + H2O → Al(OH)3↓+ HCO3–
- Phương pháp giải: nCO2 pu=nAl(OH)3
3. Mở rộng
- Đối với bài toán khi cho H+ vào dung dịch chứa hỗn hợp muối aluminat và OH– thì sẽ xảy ra các phản ứng theo trình tự sau:
+ Phản ứng trung hòa:
H+ + OH– → H2O (1)
+ Phản ứng tạo kết tủa:
AlO2– + H+ + H2O →Al(OH)3↓ (2)
+ Phản ứng hòa tan kết tủa nếu H+ còn:
Al(OH)3 + 3H+ → Al3+ + 3H2O (3)
- Công thức giải nhanh:
+ Xảy ra phản ứng (1) và (2):
nH+=nOH−+n↓
+ Xảy ra phản ứng (1), (2) và (3):
nH+=nOH−+4nAl3+−3n↓
4. Bài tập minh họa
Câu 1: Cho dung dịch X chứa 0,05 mol Na[Al(OH)4] và 0,1 mol NaOH tác dụng với dung dịch HCl 2M. Thể tích dung dịch HCl 2M lớn nhất cần cho vào dung dịch X để thu được 1,56 gam kết tủa là
A. 0,06 lít
B. 0,18 lít
C. 0,12 lít
D. 0,08 lít
Hướng dẫn giải
Nhận thấy nkết tủa = 0,02 mol < nNa[Al(OH)4]
Để thể tích dung dịch HCl là lớn nhất thì xảy ra quá trình hòa tan kết tủa
NaOH + HCl → NaCl + H2O
0,1 → 0,1
Na[Al(OH)4] + HCl → Al(OH)3 + H2O
0,02 → 0,02 → 0,02
Na[Al(OH)4] + 4HCl → AlCl3 + NaCl + 4H2O
0,03 → 0,12
Vậy nHCl = 0,1 + 0,02 + 0,12 = 0,24 mol → V= 0,12 lít.
Đáp án C
Câu 2: Thêm từ từ dung dịch HCl 0,1M vào 200ml dung dịch X chứa KOH 0,05M và NaAlO2 0,15M, thu được kết tủa. Lọc kết tủa, nung ở nhiệt độ cao đến khi khối lượng không đổi thu được 1,02 gam chất rắn. Thể tích dung dịch HCl đã dùng là
A. 0,3 lít.
B. 0,6 lít.
C. 0,7 lít.
D. 0,3 lít hoặc 0,7 lít.
Hướng dẫn giải
Ta có: nKOH = 0,01 mol
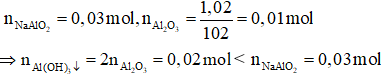
Trường hợp 1: Không xảy ra quá trình hòa tan kết tủa
Các phương trình hóa học:
H+ + OH– → H2O
AlO2– + H+ + H2O →Al(OH)3↓
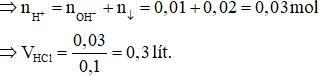
Trường hợp 2: Xảy ra quá trình hòa tan một phần kết tủa
Các phương trình hóa học:
H+ + OH– → H2O
AlO2– + H+ + H2O →Al(OH)3↓
Al(OH)3 + 3H+ → Al3+ + 3H2O
Áp dụng công thức tính nhanh ta có:
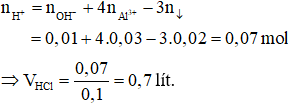
Đáp án D
Câu 3: Thêm dung dịch chứa 0,18 mol HCl vào dung dịch hỗn hợp gồm 0,1 mol NaOH và 0,1 mol NaAlO2 thu được khối lượng kết tủa là:
A. 7,8 gam
B. 6,24 gam
C. 4,68 gam
D. 3,9 gam
Hướng dẫn giải
H+ + OH– → H2O
0,1←0,1
nHCl còn lại sau phản ứng trung hòa = 0,18 - 0,1
= 0,08 mol < nNaAlO2=0,01 mol
→ Chỉ xảy ra phản ứng tạo kết tủa Al(OH)3
AlO2– + H+ + H2O →Al(OH)3↓
⇒n↓=nH+=0,08 mol⇒m↓=0,08.78=6,24g
Đáp án B
Xem thêm tổng hợp các công thức Hóa học đầy đủ, chi tiết khác:
Tổng hợp công thức Hóa học lớp 10 đầy đủ
Tổng hợp công thức Hóa học lớp 11 đầy đủ
Công thức oxit cao nhất của các nguyên tố (phổ biến)
Công thức hidroxit cao nhất của các nguyên tố (phổ biến)
Công thức hợp chất khí với hidro của các nguyên tố (phổ biến)
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.