Với bài viết về Công thức oxit (oxide) cao nhất của phân nhóm VA bao gồm nội dung về công thức oxit cao nhất, kiến thức mở rộng và bài tập vận dụng. Mời các bạn đón xem:
Nội dung bài viết
Công thức oxit (oxide) cao nhất của phân nhóm VA
I. Tổng quát về các nguyên tố nhóm VA
- Nhóm nitơ (nhóm VA) gồm các nguyên tố: N, P, As, Sb, Bi.
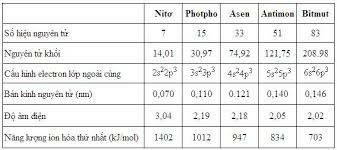
- Cấu hình e lớp ngoài cùng: ns2np3.
- Trong các hợp chất, các nguyên tố nhóm nitơ có mức oxi hóa cao nhất là +5, ngoài ra còn có các mức -3 và +3. Riêng N còn có thêm các mức oxi hóa +1, +2 và +4.
- Từ N đến Bi: tính phi kim của các nguyên tố giảm dần, đồng thời tính kim loại tăng dần; tính axit của các oxit và hidroxit giảm dần đồng thời tính bazơ của chúng tăng dần.
- Hợp chất với H của các nguyên tố nhóm VA đều có dạng RH3. Độ bền nhiệt giảm dần từ NH3 đến BiH3. Dung dịch của chúng không có tính axit.
II. Công thức oxit cao nhất của nhóm VA
Công thức oxide cao nhất của nhóm VA là: R2O5 (với R là nguyên tố nhóm VA).
Giải thích:
- Công thức oxide cao nhất của R có dạng:
+ R2On (với n thuộc nhóm A lẻ)
+ ROn/2 (với n thuộc nhóm A chẵn)
Do đó, công thức oxide cao nhất của các nguyên tố nhóm VA là: R2O5.
II. Mở rộng kiến thức
Các hợp chất dạng R2O5 đều không được tạo ra khi cho các nguyên tố tác dụng với oxygen, mà được điều chế bằng cách khử nước các oxy acid.
Ví dụ:
2H3AsO4 → As2O5 + 3H2O
2H3SbO4 → Sb2O5 + 3H2O
III. Bài tập vận dụng liên quan
Câu 1: X là nguyên tố nhóm VA. Công thức oxide cao nhất của X là
A. XO3.
B. X2O5.
C. XO2.
D. X2O3.
Hướng dẫn giải:
Đáp án B
X thuộc nhóm VA nên công thức oxide cao nhất sẽ là X2O5.
Câu 2: R là nguyên tố nhóm VA. Trong oxide cao nhất tương ứng O chiếm 74,07% về khối lượng. Công thức oxide cao nhất của R là
A. N2O5.
B. N2O3.
C. P2O5.
D. NO2.
Hướng dẫn giải:
Đáp án A
Vì R thuộc nhóm VA⇒ công thức oxide cao nhất của R là R2O5
⇒MOMR2O5.100%=74,07%⇒80(2R+80).100%=74,07%
⇒ R = 14 ⇒ R là N.
Câu 3: R là nguyên tố nhóm VA. Trong công thức oxide cao nhất tương ứng R chiếm 43,66% về khối lượng. Công thức oxide cao nhất của R là
A. N2O5.
B. As2O5.
C. P2O5.
D. NO2.
Hướng dẫn giải:
Đáp án C
Vì R thuộc nhóm VA⇒ công thức oxide cao nhất của R là R2O5
⇒MRMR2O5.100%=43,66%⇒2R2R+80.100%=43,66%
⇒ R = 31 ⇒ R là P.
Bài 4: Oxide cao nhất của nguyên tố R có dạng R2O5, được sử dụng làm chất hút ẩm cho chất lỏng và khí. Hợp chất của R với hydrogen ở thể khí có chứa 8,82% hydrogen về khối lượng, là khí rất độc, gây chết với các triệu chứng khó hô hấp, đau đầu, chóng mặt, buồn nôn. Xác định công thức phân tử của hợp chất khí của R với hydrogen.
Lời giải:
Oxide cao nhất của nguyên tố R có dạng R2O5 nên R thuộc nhóm VA.
Hợp chất với hydrogen là RH3.
Theo bài ra, ta có:
%H%R=1.3R=8,82100−8,82⇒R=31.
Vậy R là phosphorus (P), công thức hợp chất với hydrogen là PH3.
Xem thêm tổng hợp các công thức Hóa học đầy đủ, chi tiết khác:
Tổng hợp công thức Hóa học lớp 10 đầy đủ
Tổng hợp công thức Hóa học lớp 11 đầy đủ
Tổng hợp Công thức Hóa học lớp 12 đầy đủ
Công thức hidroxit cao nhất của các nguyên tố (phổ biến)
Công thức hợp chất khí với hidro của các nguyên tố (phổ biến)
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.