Với bài viết về Công thức oxit cao nhất của Cacbon (C) bao gồm nội dung về công thức oxit cao nhất, kiến thức mở rộng và bài tập vận dụng. Mời các bạn đón xem:
Nội dung bài viết
Công thức oxit cao nhất của Cacbon (C)
I. Công thức oxit cao nhất của C
Công thức oxide cao nhất của carbon là: CO2.
Giải thích:
C (Z = 6) có cấu hình electron là: 1s22s22p2.
⇒ Carbon thuộc nhóm IVA trong bảng tuần hoàn, có hoá trị cao nhất với oxygen là IV.
Do đó, công thức oxide cao nhất của carbon là: CO2.
II. Mở rộng kiến thức về CO2
1. Cấu tạo phân tử
- Cấu tạo của CO2 là O=C=O.
- Phân tử CO2 có cấu tạo thẳng, không phân cực.
2. Tính chất vật lý
- Là chất khí không màu, nặng gấp 1,5 lần không khí.
- Tan ít trong nước.
- CO2 khi bị làm lạnh đột ngột chuyển sang trạng thái rắn,gọi là nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
Lưu ý: Khi sử dụng đá khô phải đeo gang tay chống lạnh để tránh bị bỏng lạnh khi tiếp xúc với đá khô.
3. Tính chất hóa học
- Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
- CO2 là acidic oxide, khi tan trong nước tạo thành carbonic acid.
CO2 + H2O ⇌ H2CO3
- Ngoài ra, CO2 còn tác dụng với basic oxidevà dung dịch base (kiềm).
Ví dụ:
CaO + CO2 CaCO3
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
4. Điều chế
a. Trong phòng thí nghiệm
- CO2 được điều chế bằng cách cho dung dịch HCl tác dụng với đá vôi.
- Phương trình hóa học:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
b. Trong công nghiệp
- Khí CO2 được thu hồi từ quá trình đốt cháy hoàn toàn than để cung cấp năng lượng cho các quá trình sản xuất khác.
C + O2 CO2
- Ngoài ra, khí CO2 còn được thu hồi từ quá trình chuyển hóa khí thiên nhiên, các sản phẩm dầu mỏ; quá trình nung vôi; quá trình lên men rượu (alcohol) từ đường glucose.
CaCO3 CaO + CO2
C6H12O6 2CO2 + 2C2H5OH
5. Ứng dụng
- CO2 lỏng được dùng để tạo gas cho thức uống, và trung hòa nước thải. CO2 còn được sử dụng trong việc làm các loại bánh nướng: Thường người ta sử dụng bột nở để làm bánh nướng. Bột nở sản sinh ra khí carbon dioxide làm bánh phồng lên.
- CO2 thường được sử dụng trong các áo phao cứu hộ hay những ống hơi trong súng hơi, trong bơm xe đạp. Ứng dụng trong lĩnh vực chữa cháy cứu hỏa.
- CO2 được sử dụng làm đá khô dùng trong y tế và ứng dụng trong các nhà kính để cung cấp khí cho thực vật.
III. Bài tập vận dụng liên quan
Câu 1: Hình vẽ sau đây mô tả thí nghiệm điều chế và thu khí Y từ hỗn hợp rắn gồm CaCO3 và CaSO3:
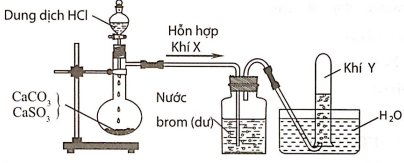
Khí Y là
A. CO2.
B. SO2.
C. H2.
D. Cl2.
Hướng dẫn giải:
Đáp án A
Câu 2: Chất khí nào sau đây được tạo ra từ bình chữa cháy và được dùng để sản xuất thuốc giảm đau dạ dày?
A. CO2.
B. N2.
C. CO.
D. CH4.
Hướng dẫn giải:
Đáp án A
Chất khí được tạo ra từ bình chữa cháy là CO2.
Thuốc giảm đau dạ dày là NaHCO3.
NaOH + CO2 → NaHCO3.
Câu 3: Hỗn hợp khí X gồm CO2 và SO2. Khí SO2 khi đi qua bình đựng nước brom đã bị giữ lại, còn khí Y thoát ra là CO2.
Khi đốt rơm rạ trên các cánh đồng sau những vụ thu hoạch lúa sinh ra nhiều khói bụi, trong đó có khí X. Khí X nặng hơn không khí và gây hiệu ứng nhà kính. Khí X là
A. N2.
B. O2.
C. CO.
D. CO2.
Hướng dẫn giải:
Đáp án D
Khí gây ra hiệu ứng nhà kính là khí CO2.
Xem thêm tổng hợp các công thức Hóa học đầy đủ, chi tiết khác:
Tổng hợp công thức Hóa học lớp 10 đầy đủ
Tổng hợp công thức Hóa học lớp 11 đầy đủ
Tổng hợp Công thức Hóa học lớp 12 đầy đủ
Công thức hidroxit cao nhất của các nguyên tố (phổ biến)
Công thức hợp chất khí với hidro của các nguyên tố (phổ biến)
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.