Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
CH3COONa + H2O ⇌ CH3COOH + NaOH
Chuẩn bị: dung dịch CH3COONa 0,5M, phenolphthalein; cốc nước nóng, cốc nước đá, 3 ống nghiệm.
Tiến hành:
- Cho khoảng 10 mL dung dịch CH3COONa 0,5 M vào cốc thuỷ tinh, thêm 1 – 2 giọt phenolphthalein, khuấy đều.
- Chia dung dịch thu được vào 3 ống nghiệm. Ống nghiệm (1) để so sánh, ống nghiệm (2) ngâm vào cốc nước đá, ống nghiệm (3) ngâm vào cốc nước nóng.
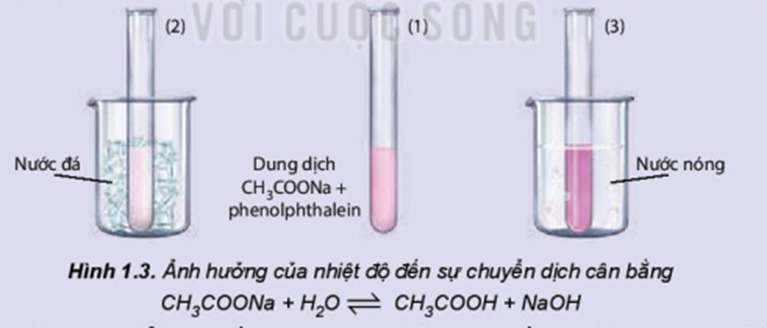
Quan sát sự thay đổi màu sắc của dung dịch trong các ống nghiệm và hoàn thành vào vở theo mẫu bảng sau:

 Giải bởi Vietjack
Giải bởi Vietjack
|
Tác động |
Hiện tượng |
Chiều chuyển dịch cân bằng (thuận/ nghịch) |
Chiều chuyển dịch cân bằng (phản ứng toả nhiệt/ phản ứng thu nhiệt) |
|
Tăng nhiệt độ |
Dung dịch trong ống nghiệm đậm màu hơn |
Thuận |
Phản ứng thu nhiệt |
|
Giảm nhiệt độ |
Dung dịch trong ống nghiệm nhạt màu hơn |
Nghịch |
Phản ứng toả nhiệt |
Trong công nghiệp, khí hydrogen được điều chế như sau:
Cho hơi nước đi qua than nung nóng, thu được hỗn hợp khí CO và H2 (gọi là khí than ướt):
C(s) + H2O(g) ⇌ CO(g) + H2(g)
Trộn khí than ướt với hơi nước, cho hỗn hợp đi qua chất xúc tác Fe2O3:
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
a) Vận dụng nguyên lí Le Chatelier, hãy cho biết cần tác động yếu tố nhiệt độ như thế nào để các cân bằng (1), (2) chuyển dịch theo chiều thuận.
Ammonia (NH3) được điều chế bằng phản ứng: N2(g) + 3H2(g) ⇌ 2NH3(g)
Ở toC, nồng độ các chất ở trạng thái cân bằng là:
[N2] = 0,45 M; [H2] = 0,14 M; [NH3] = 0,62 M.
Tính hằng số cân bằng KC của phản ứng trên tại t oC.
b) Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 – 5 lần) so với khí carbon monoxide. Giải thích.
Cho các nhận xét sau:
a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
b) Ở trạng thái cân bằng, các chất không phản ứng với nhau.
c) Ở trạng thái cân bằng, nồng độ các chất sản phẩm luôn lớn hơn nồng độ các chất đầu. d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Các nhận xét đúng là
Trong cơ thể người, hemoglobin (Hb) kết hợp với oxygen theo phản ứng thuận nghịch được biểu diễn đơn giản như sau:
Hb + O2 ⇌ HbO2
Ở phổi, nồng độ oxygen lớn nhất nên cân bằng trên chuyển dịch sang phải, hemoglobin kết hợp với oxygen. Khi đến các mô, nồng độ oxygen thấp, cân bằng trên chuyển dịch sang trái, giải phóng oxygen. Nếu thiếu oxygen ở não, con người có thể bị đau đầu, chóng mặt.
a) Vận dụng nguyên lí chuyển dịch cân bằng Le Chatelie, em hãy đề xuất biện pháp để oxygen lên não được nhiều hơn?
Quá trình hình thành hang động, thạch nhũ là một ví dụ điển hình về phản ứng thuận nghịch trong tự nhiên.
Nước có chứa CO2 chảy qua đá vôi, bào mòn đá tạo thành Ca(HCO3)2 (phản ứng thuận) góp phần hình thành các hang động. Hợp chất Ca(HCO3)2 trong nước lại bị phân huỷ tạo ra CO2 và CaCO3 (phản ứng nghịch), hình thành các thạch nhũ, măng đá, cột đá.
Viết phương trình hoá học của các phản ứng xảy ra trong hai quá trình trên.
Viết biểu thức hằng số cân bằng cho các phản ứng sau:
a) Phản ứng tổng hợp ammonia: N2(g) + 3H2(g) ⇌ 2NH3(g).
b) Phản ứng nung vôi: CaCO3(s) ⇌ CaO(s) + CO2(g)
Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
2NO2(g) ⇌ N2O4(g)
(màu nâu đỏ) (không màu)
Chuẩn bị: 3 ống nghiệm chứa khí NO2 nút kín có màu giống nhau, cốc nước đá, cốc nước nóng.
Tiến hành:
- Ống nghiệm (1) để so sánh.
- Ngâm ống nghiệm (2) vào cốc nước đá trong khoảng 1 – 2 phút.
- Ngâm ống nghiệm (3) vào cốc nước nóng trong khoảng 1 – 2 phút.
Lưu ý: NO2 là một khí độc, chú ý nút kín ống nghiệm.
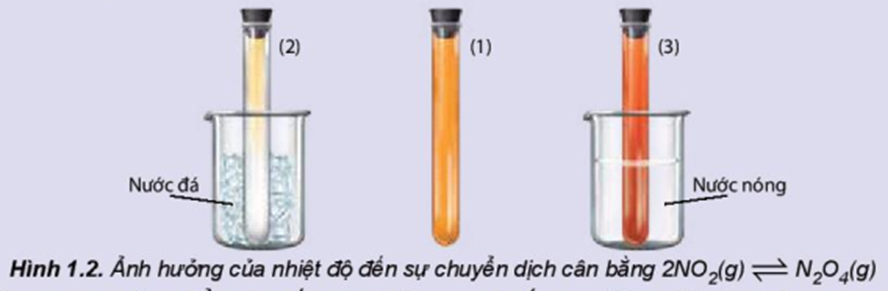
Quan sát sự thay đổi màu sắc của khí trong các ống nghiệm và hoàn thành vào vở theo mẫu bảng sau:

b) Khi lên núi cao, một số người cũng gặp hiện tượng bị đau đầu, chóng mặt. Dựa vào cân bằng trên, em hãy giải thích hiện tượng này.
Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)
Thực hiện phản ứng trên ở trong bình kín, ở nhiệt độ 445 oC với các nồng độ ban đầu khác nhau. Số liệu về nồng độ các chất ở thời điểm ban đầu và trạng thái cân bằng trong các thí nghiệm được trình bày trong Bảng 1.2.
Bảng 1.2. Nồng độ các chất của phản ứng H2(g) + I2(g) ⇌ 2HI(g) ở thời điểm ban đầu và ở trạng thái cân bằng.
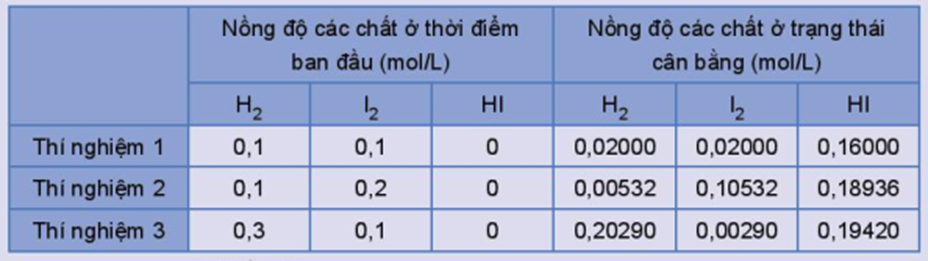
Tính giá trị ở mỗi thí nghiệm, nhận xét kết quả thu được.
c) Viết biểu thức định luật tác dụng khối lượng đối với phản ứng thuận và phản ứng nghịch, từ đó dự đoán sự thay đổi tốc độ của mỗi phản ứng theo thời gian (biết các phản ứng này đều là phản ứng đơn giản).
Nghiên cứu ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng:
CH3COONa + H2O ⇌ CH3COOH + NaOH
Thí nghiệm nghiên cứu ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng trên được thực hiện như sau:
- Cho một vài giọt phenolphthalein vào dung dịch CH3COONa, lắc đều, dung dịch có màu hồng nhạt.
- Chia dung dịch thu được vào 3 ống nghiệm với thể tích gần bằng nhau. Ống nghiệm (1) để so sánh, ống nghiệm (2) thêm vài tinh thể CH3COONa, ống nghiệm (3) thêm một vài giọt dung dịch CH3COOH.
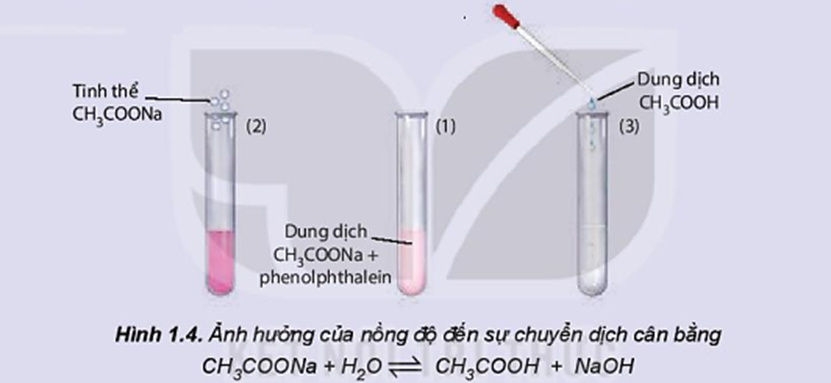
Quan sát sự thay đổi màu sắc của dung dịch trong các ống nghiệm (Hình 1.4) và hoàn thành vào vở theo mẫu bảng sau:

CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.