Với Giải SBT Hóa học 10 trang 32 trong Bài 9: Liên kết ion Sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 trang 32.
Nội dung bài viết
SBT Hóa học 10 trang 32
Bài 9.9 trang 32 sách bài tập Hóa học 10: Trong đời sống, muối ăn (NaCl) và các gia vị, phụ gia (C5H8NO4Na: bột ngọt; C7H5O2Na: chất bảo quản thực phẩm) đều có chứa ion sodium. Hiệp hội Tim mạch Hoa Kỳ khuyến cáo các cá nhân nên hạn chế lượng sodium xuống dưới 2 300 mg mỗi ngày vì nếu tiêu thụ nhiều hơn sẽ ảnh hưởng đến tim mạch và thận. Nếu trung bình mỗi ngày, một người dùng tổng cộng 5,0 gam muối ăn; 0,5 gam bột ngọt và 0,05 gam chất bảo quản thì lượng sodium tiêu thụ có vượt mức giới hạn cho phép nói trên không?
Lời giải:
Chú ý:
MNaCl = 58,5; MC5H8NO4Na=169;MC7H5O2Na=144 nên lượng sodium người đó tiêu thụ trong một ngày là:
558,5.23+0,5169.23+0,05144.23=2,042g.
Có 2,042 gam = 2042 mg < 2300 gam.
Vậy lượng sodium tiêu thụ này còn nằm trong giới hạn cho phép.
Bài 9.10 trang 32 sách bài tập Hóa học 10: Trình bày cách vẽ một ô mạng tinh thể NaCl
Lời giải:
Bước 1: Vẽ một khối lập phương
Bước 2: Chia khối lập phương đã vẽ thành 8 khối lập phương nhỏ bằng cách nối điểm giữa của mỗi cạnh với điểm giữa của cạnh đối diện và điểm giữa của mỗi mặt với điểm giữa của mặt đối diện.
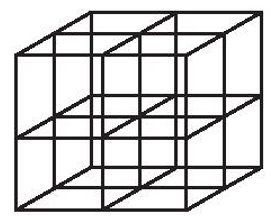
Bước 3: Đặt các ion sodium và ion chloride vào các đỉnh của khối lập phương và các điểm giữa của các cạnh cùng các mặt. Chú ý, ion chlorine có kích thước lớn hơn ion sodium. Tâm của khối lập phương không nhất thiết phải là ion sodium hay chlorine, nhưng bắt buộc các ion trái dấu phải luân phiên nhau trong không gian của mạng tinh thể.
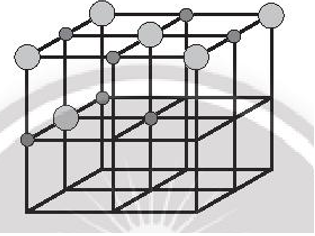
Bước 4: Tinh thể NaCl đã hoàn chỉnh:
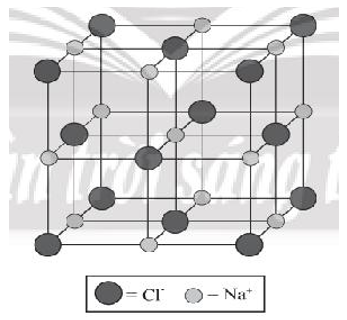
Bài 9.11 trang 32 sách bài tập Hóa học 10: Biểu đồ dưới đây cho biết mối quan hệ giữa năng lượng của hệ các ion trái dấu so với khoảng cách giữa chúng:

Biểu đồ cho thấy khoảng cách giữa các ion càng gần càng thuận lợi để hệ đạt được trạng thái năng lượng tối thiểu (bền vững). Tuy nhiên, ở khoảng cách nhỏ quá, các ion lại đẩy nhau do hạt nhân của các ion đều mang điện tích dương. Năng lượng tối thiểu đại diện cho độ bền liên kết và khoảng cách ro tại mức năng lượng tối thiểu gọi là độ dài liên kết. Bằng cách thực hiện một loạt các phép tính, người ta thấy rằng các hợp chất ion được hình thành bởi các ion có điện tích lớn hơn sẽ tạo ra liên kết mạnh hơn và các chất ion có độ dài liên kết ngắn hơn sẽ hình thành liên kết mạnh hơn.
Sử dụng nhận định trên để dự đoán và giải thích độ bền liên kết giữa các hợp chất ion sau:
a. NaCl và Na2O
b. NaCl và NaF
Lời giải:
Do hợp chất ion được hình thành bởi các ion có điện tích lớn hơn sẽ tạo ra liên kết bền hơn và các hợp chất ion có độ dài liên kết ngắn hơn sẽ hình thành liên kết bền hơn nên:
a) NaCl và Na2O
Ion O2- có điện tích lớn hơn ion Cl-, ngoài ra kích thước ion O2- lại nhỏ hơn ion Cl- nên liên kết trong Na2O bền hơn so với NaCl.
b) NaCl và NaF
Tuy các ion Cl- và F- có cùng điện tích, nhưng kích thước ion F- nhỏ hơn ion Cl- nên liên kết trong NaF bền hơn trong NaCl.
Kết quả thực nghiệm đã chứng minh:
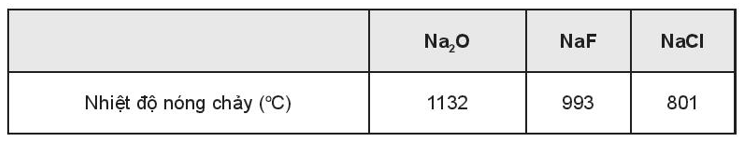
Bài 9.12 trang 32 sách bài tập Hóa học 10: X, Y, Z là các hợp chất ion thuộc trong số các chất sau: NaF, MgO và MgCl2. Nhiệt độ nóng chảy của các hợp chất X, Y, Z được thể hiện qua biểu đồ:
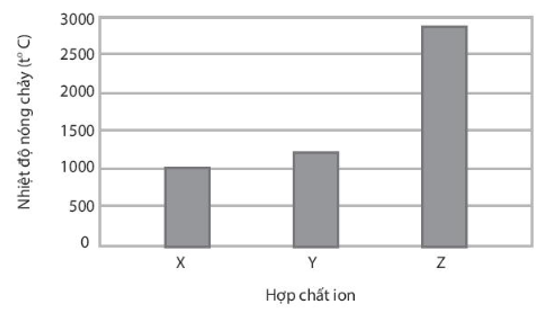
Trình bày cách xác định các chất X, Y, Z.
Lời giải:
Nhiệt độ nóng chảy của hợp chất ion là nhiệt độ tại đó có đủ năng lượng dưới dạng nhiệt để phá vỡ lực hút tĩnh điện mạnh giữa các ion và phá vỡ cấu trúc mạng tinh thể chuyển từ thể rắn sang thể lỏng.
Hợp chất ion có liên kết bền hơn sẽ có nhiệt độ nóng chảy cao hơn.
- Do điện tích anion hình thành hợp chất MgO cao hơn so với điện tích anion hình thành hợp chất MgF2, trong khi bán kính anion O2- và F- là khác biệt không đáng kể (O và F cùng thuộc chu kì 2) nên MgF2 phải có nhiệt độ nóng chảy thấp hơn MgO.
- Do điện tích cation hình thành hợp chất MgF2 cao hơn điện tích cation hình thành hợp chất NaF, trong khi bán kính cation Mg2+ lại nhỏ hơn bán kính cation Na+ nên NaF phải có nhiệt độ nóng chảy thấp hơn MgF2.
Vậy X là NaF; Y là MgF2 và Z là MgO.
Xem thêm lời giải vở bài tập Hóa học lớp 10 Chân trời sáng tạo với cuộc sống hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.