Với Giải SBT Hóa học 10 trang 36 trong Bài 10: Liên kết cộng hóa trị Sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 trang 36.
Nhận xét điểm giống nhau và khác nhau giữa liên kết ion và liên kết cộng hóa trị
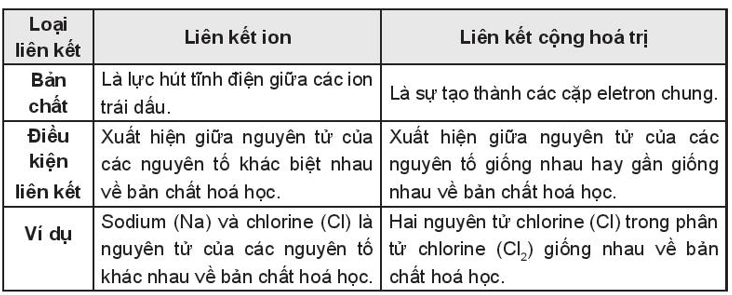
Bài 10.17 trang 36 SBT Hóa học 10: Nhận xét điểm giống nhau và khác nhau giữa liên kết ion và liên kết cộng hóa trị. Cho ví dụ.
Lời giải:
- Giống nhau: Liên kết ion và liên kết cộng hóa trị đều là nguyên nhân giúp các nguyên tử hình thành nên phân tử, trong đó các nguyên tử trong phân tử đều đạt được cơ cấu bền vững của khí hiếm gần nhất. Ví dụ:
+ Liên kết ion là nguyên nhân hình thành liên kết giữa nguyên tử sodium và nguyên tử chlorine để tạo nên phân tử sodium chloride. Trong phân tử sodium chloride các nguyên tử sodium và chlorine đều đạt cơ cấu bền vững giống khí hiếm.
+ Liên kết cộng hóa trị là nguyên nhân hình thành liên kết giữa hai nguyên tử chlorine tạo nên phân tử chlorine. Trong phân tử chlorine, nguyên tử Cl đã đạt cơ cấu bền vững giống khí hiếm.
- Khác nhau:
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo với cuộc sống hay, chi tiết khác:
Bài 10.1 trang 34 sách bài tập Hóa học 10: Trong phân tử ammonia (NH3), số cặp electron chung giữa nguyên tử nitrogen và các nguyên tử hydrogen là...
Bài 10.2 trang 34 sách bài tập Hóa học 10: Biết nguyên tử chlorine có 7 electron hóa trị, công thức electron của phân tử chlorine là:...
Bài 10.3 trang 34 sách bài tập Hóa học 10: Chất nào sau đây không có liên kết cộng hóa trị phân cực?...
Bài 10.4 trang 34 sách bài tập Hóa học 10: Chất vừa có liên kết cộng hóa trị phân cực, vừa có liên kết cộng hóa trị không phân cực là...
Bài 10.5 trang 34 sách bài tập Hóa học 10: Sử dụng giá trị độ âm điện các nguyên tố được cho trong bảng sau để trả lời các câu 10.5, 10.6, 10.7...
Bài 10.6 trang 34 sách bài tập Hóa học 10: Sử dụng giá trị độ âm điện các nguyên tố được cho trong bảng sau để trả lời các câu 10.5, 10.6, 10.7...
Bài 10.7 trang 35 sách bài tập Hóa học 10: Sử dụng giá trị độ âm điện các nguyên tố được cho trong bảng sau để trả lời các câu 10.5, 10.6, 10.7...
Bài 10.8 trang 35 sách bài tập Hóa học 10:Hợp chất nào sau đây chứa cả liên kết cộng hóa trị và liên kết ion?...
Bài 10.9 trang 35 sách bài tập Hóa học 10:Các liên kết trong phân tử nitrogen được tạo thành do sự xen phủ của...
Bài 10.10 trang 35 sách bài tập Hóa học 10:Điều nào sau đây sai khi nói về tính chất của hợp chất cộng hóa trị?...
Bài 10.11 trang 35 sách bài tập Hóa học 10:Đặt độ dài các liên kết N – N, N = N và N ≡ N lần lượt là I1, I2 và I3...
Bài 10.12 trang 35 sách bài tập Hóa học 10:Phát biểu nào sau đây đúng với độ bền của một liên kết?...
Bài 10.13 trang 35 sách bài tập Hóa học 10:Ammonia (NH3) khan (nguyên chất) được bơm vào đất ở dạng khí, là nguồn phân đạm phổ biến...
Bài 10.14 trang 36 sách bài tập Hóa học 10: Viết công thức electron, công thức Lewis và công thức cấu tạo của:...
Bài 10.15 trang 36 sách bài tập Hóa học 10: Ozone (O3) là một loại khí có tính oxi hóa mạng, phân tử gồm ba nguyên tử oxygen...
Bài 10.16 trang 36 sách bài tập Hóa học 10: Ammonium là chất thải của quá trình trao đổi chất ở động vật...
Bài 10.18 trang 36 sách bài tập Hóa học 10: Hydrogen sulfide (H2S) là một chất khí không màu, mùi trứng thối, độc...
Bài 10.19 trang 36 sách bài tập Hóa học 10: Vẽ sơ đồ biểu diễn sự xen phủ giữa orbital 1s của nguyên tử hydrogen và orbital 3p...
Bài 10.20 trang 36 sách bài tập Hóa học 10: Nhận xét mối tương quan giữa độ dài liên kết và năng lượng liên kết dựa theo bảng sau:...
Bài 10.21 trang 37 sách bài tập Hóa học 10: Giải thích vì sao độ âm điện của nitrogen là 3,04 xấp xỉ với độ âm điện của chlorine là 3,16...
Bài 10.22 trang 37 sách bài tập Hóa học 10: Dưới đây là biểu đồ tương tác của hai nguyên tử hydrogen ở thể khí so với khoảng cách hạt nhân giữa chúng:...
Bài 10.23 trang 37 sách bài tập Hóa học 10: Sodium chloride tan được trong nước hay trong dầu hỏa? Giải thích...
Bài 10.24 trang 37 sách bài tập Hóa học 10: Vì sao benzene (C6H6) không tan trong nước nhưng tan tốt trong các dung môi hữu cơ...
Bài 10.25 trang 37 sách bài tập Hóa học 10: Biết phân tử BF3 có cấu trúc phẳng, phân tử CCl4 có cấu trúc hình tứ diện đều...
Bài 10.26 trang 38 sách bài tập Hóa học 10: a. Ở 25oC và 0,99 atm, khả năng tan của carbon dioxide (CO2) trong nước là 1,45 gam/L...
Xem thêm các bài giải SBT Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
