Với Giải SBT Hóa học 10 trang 57 trong Bài 14: Tính biến thiên enthalpy của phản ứng hóa học Sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 trang 57.
Kim loại nhôm có thể khử được oxide của nhiều nguyên tố
Bài 14.7 trang 57 SBT Hóa học 10: Kim loại nhôm có thể khử được oxide của nhiều nguyên tố. Dựa vào nhiệt tạo thành chuẩn của các chất (Bảng 13.1 SGK), tính biến thiên enthalpy của phản ứng nhôm khử 1 mol mỗi oxide sau
a) Fe3O4(s)
b) Cr2O3(s)
Phương pháp giải:
Dựa vào công thức tính: và bảng số liệu
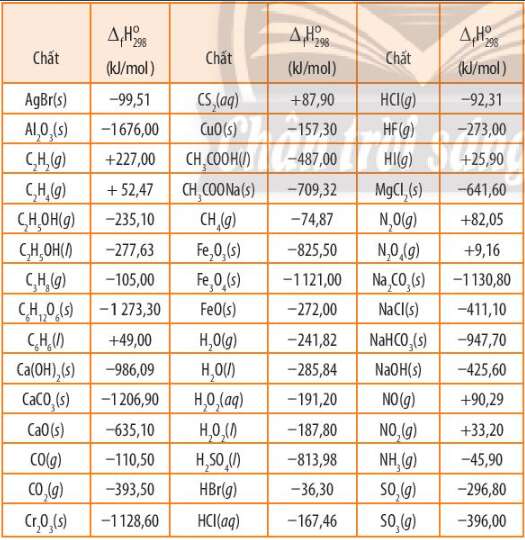
Lời giải:
- Biến thiên enthalpy của phản ứng 8Al(s) + 3Fe3O4(s) 9Fe(s) + 4Al2O3(s) là:
=> (Do của đơn chất = 0)
=>
=> Biến thiên enthalpy của phản ứng nhôm khử 1 mol Fe3O4 là
- Biến thiên enthalpy của phản ứng 2Al(s) + Cr2O3(s) 2Cr(s) + Al2O3(s) là:
=> (Do của đơn chất = 0)
=>
=> Biến thiên enthalpy của phản ứng nhôm khử 1 mol Cr2O3 là
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.