Với giải Câu hỏi trang 34 SGK Hoá học10 Chân trời sáng tạo trong Bài 4: Cấu trúc lớp vỏ electron của nguyên tử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Nội dung bài viết
Hoá học 10 Chân trời sáng tạo trang 34 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
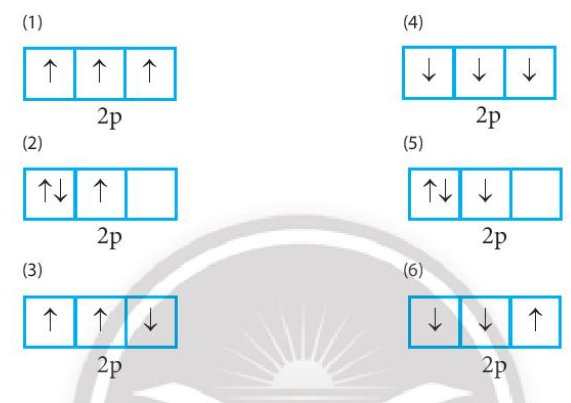
Phương pháp giải:
- Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa
- AO chứa electron độc thân: ↑
- AO chứa electron ghép đôi: ↑↓
Lời giải:
(1): đúng vì chứa tối đa electron và biểu diễn electron độc thân bằng mũi tên đi lên
(2): sai vì số electron độc thân chưa tối đa
(3): sai vì biểu diễn 1 electron độc thân bằng mũi tên đi xuống
(4): sai vì biểu diễn electron độc thân bằng mũi tên đi xuống
(5): sai vì số electron độc thân chưa tối đa, biểu diễn electron độc thân bằng mũi tên đi xuống
(6): sai vì biểu diễn 2 electron độc thân bằng mũi tên đi xuống
Phương pháp giải:
- Lớp thứ nhất: có 1 phân lớp là 1s
- Lớp thứ 2: có 2 phân lớp là 2s và 2p
Lời giải:
- Lớp thứ nhất: có 1 phân lớp là 1s
- Lớp thứ 2: có 2 phân lớp là 2s và 2p
- Phân lớp s chứa tối đa 2 electron, phân lớp p chứa tối đa 6 electron
=> Cấu hình electron của nguyên tố X: 1s22s22p4
=> Nguyên tố X có 8 electron
=> Số hiệu nguyên tử của X: Z = 8
a) Boron
b) Oxygen
c) Phosphorus
d) Chlorine
Phương pháp giải:
Bước 1: Xác định số electron
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng:
1s 2s 2p 3s 3p 4s 3d 4p
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng
Bước 4: Xác định số electron độc thân
Lời giải
a) Boron (Z = 5): 1s22s22p1 => Có 1 electron độc thân
b) Oxygen (Z = 8): 1s22s22p4 => Có 2 electron độc thân
c) Phosphorus (Z = 15): 1s22s22p63s23p3 => Có 3 electron độc thân
d) Chlorine (Z = 17): 1s22s22p63s23p5 => Có 1 electron độc thân
Bài tập 4 trang 34 Hoá học 10: Viết cấu hình electron nguyên tử của các nguyên tố: carbon (Z = 6), sodium (Z = 11) và oxygen (Z = 8). Cho biết số electron lớp ngoài cùng trong nguyên tử của các nguyên tố trên. Chúng là kim loại, phi kim hay khí hiếm
Phương pháp giải:
Bước 1: Xác định số electron
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng:
1s 2s 2p 3s 3p 4s 3d 4p
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng
Bước 4: Xác định số electron ở lớp ngoài cùng
+ Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là các nguyên tử của nguyên tố kim loại
+ Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là nguyên tử của các nguyên tố phi kim
+ Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim
+ Nguyên tử có 8 electron ở lớp ngoài cùng là nguyên tử của nguyên tố khí hiếm
Lời giải:
- Nguyên tố Carbon (Z = 6): 1s22s22p2 => Có 4 electron ở lớp ngoài cùng, là nguyên tố phi kim
- Nguyên tố Sodium (Z = 11): 1s22s22p63s1 => Có 1 electron ở lớp ngoài cùng, là nguyên tố kim loại
- Nguyên tố Oxygen (Z = 8): 1s22s22p4 => Có 6 electron ở lớp ngoài cùng, là nguyên tố phi kim
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi mở đầu trang 26 Hoá học 10: Trong nguyên tử, các electron chuyển động như thế nào và chiếm những mức năng lượng nào?...
Câu hỏi 14 trang 32 Hoá học 10: Cấu hình electron của một nguyên tử cho biết những thông tin gì?...
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hoá học
Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.