Với giải Câu hỏi trang 92 SGK Hoá học10 Chân trời sáng tạo trong Bài 14: Tính biến thiên enthalpy của phản ứng hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Chân trời sáng tạo trang 92 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
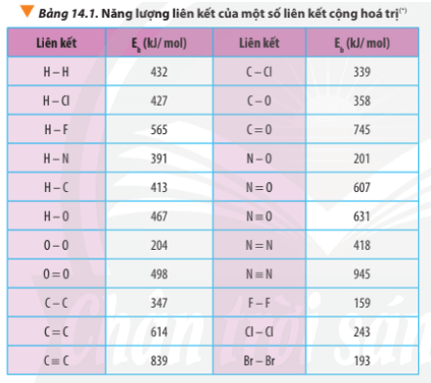
a) N2H4(g) → N2(g) + 2H2(g)
b) 4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)
Lời giải:
a) N2H4(g) → N2(g) + 2H2(g)
∆ r = Eb(N2H4) – Eb(N2) – 2.Eb(H2)
∆ r = Eb(N-N) + 4.Eb(N-H) – Eb(N≡N) – 2.Eb(H-H)
∆ r = 163 + 4.391 – 945 – 2.432 = -82 kJ
b) 4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)
∆ r = 4.Eb(HCl) + Eb(O2) – 2Eb(Cl2) – 2Eb(H2O)
∆ r = 4.Eb(H-Cl) + Eb(O=O) – 2.Eb(Cl-Cl) – 2.2.Eb(O-H)
∆ r = 4.427 + 498 -2.243 – 2.2.467 = -148 kJ
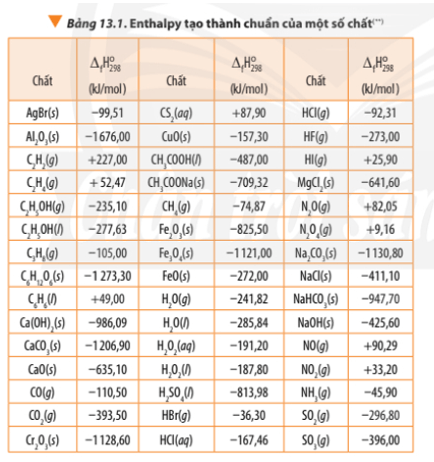
Bài 2 trang 92 Hóa học 10: Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Lời giải:
C6H6(l) + O2(g) 6CO2(g) + 3H2O(l)
∆ r = 6.∆ f(CO2) + 3. ∆ f(H2O) - ∆ f(C6H6) - ∆ f(O2)
∆ r = 6.(-393,50) + 3.(-285,84) – (+49,00) - .0
∆ r = -3267,52 kJ
1,0 gam C6H6(l) ứng với mol C6H6(l)
Đốt cháy 1 mol C6H6(l) tỏa ra 3267,52 kJ nhiệt lượng
⇒ Đốt cháy mol C6H6(l) tỏa ra là .3267,52 = 41,89 kJ nhiệt lượng
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
∆ r = 3.∆ f(CO2) + 4. ∆ f(H2O) - ∆ f(C3H8) – 5.∆ f(O2)
∆ r = 3.(-393,50) + 4.(-285,84) – (-105,00) - 5.0
∆ r = -2218,86 kJ
1,0 gam C3H8(g) ứng với mol C3H8(g)
Đốt cháy 1 mol C3H8(g) tỏa ra 2218,86 kJ nhiệt lượng
⇒ Đốt cháy mol C3H8(g) tỏa ra là .2218,86 = 50,43 kJ nhiệt lượng
Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) nhiều hơn khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 3 trang 89 Hóa học 10: Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng và giải thích vì sao nitrogen (N≡N) chỉ phản ứng với oxygen (O=O)...
Luyện tập trang 89 Hóa học 10: Xác định ∆ r của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1...
Luyện tập trang 90 Hóa học 10: Tính ∆ r của hai phản ứng sau..
Bài 2 trang 92 Hóa học 10: Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l)..
Bài 4 trang 93 Hóa học 10: Cho phương trình nhiệt hóa học sau...
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hướng đến tốc độ phản ứng hoá học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.