Với giải Câu hỏi trang 93 SGK Hoá học10 Chân trời sáng tạo trong Bài 14: Tính biến thiên enthalpy của phản ứng hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Chân trời sáng tạo trang 93 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Từ kết quả tính được ở trên, hãy rút ra ý nghĩa của dấu và giá trị ∆ r đối với phản ứng.
Lời giải:
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
∆ r = 2.∆ f(Fe) + ∆ f(Al2O3) – 2. ∆ f(Al) - ∆ f(Fe2O3)
∆ r = 2.0 + (-1676,00) – 2.0 – (-825,5)
∆ r = -850,5 kJ < 0
⇒ Phản ứng nhiệt nhôm sinh ra một lượng nhiệt rất lớn.
Bài 4 trang 93 Hóa học 10: Cho phương trình nhiệt hóa học sau:
SO2(g) + O2(g) SO3(g) ∆ r = -98,5 kJ
a) Tính lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3.
b) Giá trị ∆ r của phản ứng: SO3(g) → SO2(g) + O2(g) là bao nhiêu?
Lời giải:
a) 74,6 g SO2 tương ứng với mol SO2
Đốt cháy hoàn toàn 1 mol SO2(g) sinh ra 98,5 kJ nhiệt lượng
⇒ Đốt cháy hoàn toàn mol SO2(g) sinh ra 98,5. = 114,81 kJ nhiệt lượng
b) Lượng nhiệt giải phóng ra khi chuyển 1 mol SO2 thành 1 mol SO3 là 98,5 kJ
⇒ Lượng nhiệt cần cung cấp để phân hủy 1 mol SO3 cũng là 98,5 kJ
2H2(g) + O2(g) → 2H2O(g) ∆ r = -483,64 kJ
a) Nước hay hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn? Giải thích.
b) Vẽ sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen.
Lời giải:
a) ∆ r = Σ∆ f(sp) - Σ ∆ f(cđ) < 0
⇔ Σ∆ f(sp) < Σ ∆ f(cđ)
Vậy hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn nước.
b) Sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen.
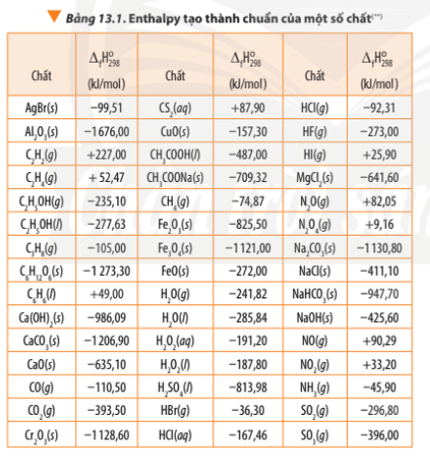
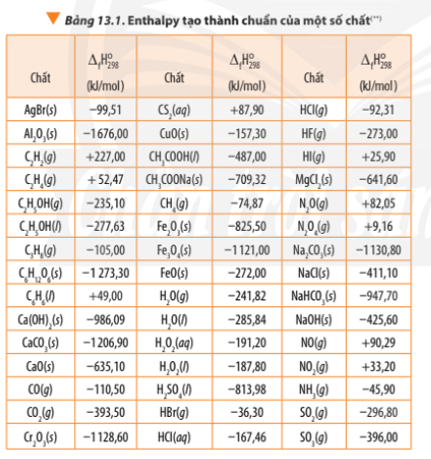
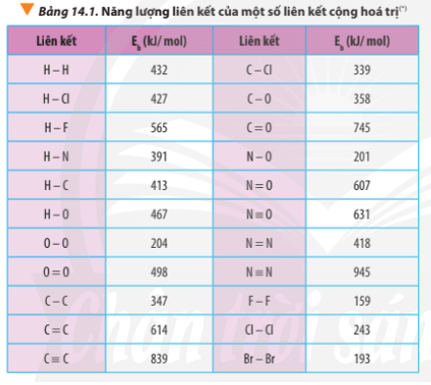
Tính biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành của hợp chất (Bảng 13.1) và dựa vào năng lượng liên kết (Bảng 14.1). So sánh hai giá trị đó và rút ra kết luận.
Lời giải:
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
Tính theo nhiệt tạo thành của hợp chất:
∆ r = 3.∆ f(CO2) + 4. ∆ f(H2O) - ∆ f(C3H8) – 5.∆ f(O2)
∆ r = 3.(-393,50) + 4.(-241,82) – (-105,00) - 5.0
∆ r = -2042,78 kJ
Tính theo năng lượng liên kết:
∆ r = Eb(C3H8) + 5.Eb(O2) – 3Eb(CO2) – 4Eb(H2O)
∆ r = 2.Eb(C-C) + 8.Eb(C-H) + 5.Eb(O=O) -3.2.Eb(C=O) - 4.2.Eb(O-H)
∆ r = 2.347 + 8.413 + 5.498 – 3.2.745 – 4.2.467
∆ r = -1718 kJ
Hai giá trị tính được gần bằng nhau.
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 3 trang 89 Hóa học 10: Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng và giải thích vì sao nitrogen (N≡N) chỉ phản ứng với oxygen (O=O)...
Luyện tập trang 89 Hóa học 10: Xác định ∆ r của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1...
Luyện tập trang 90 Hóa học 10: Tính ∆ r của hai phản ứng sau..
Bài 2 trang 92 Hóa học 10: Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l)..
Bài 4 trang 93 Hóa học 10: Cho phương trình nhiệt hóa học sau...
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hướng đến tốc độ phản ứng hoá học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.