Với giải Câu hỏi trang 111 SGK Hoá học10 Chân trời sáng tạo trong Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Chân trời sáng tạo trang 111 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Câu hỏi 12 trang 111 Hóa học 10: Tiến hành thí nghiệm 1, quan sát và ghi nhận hiện tượng.
Thí nghiệm 1: So sánh tính chất hóa học của halogen
Hóa chất: dung dịch NaBr, NaI, nước chlorine, nước bromine và dung dịch hồ tinh bột.
Dụng cụ: ống nghiệm, ống hút nhỏ giọt, kẹp gỗ, giá để ống nghiệm.
Tiến hành: Thực hiện các bước theo Bảng 17.3
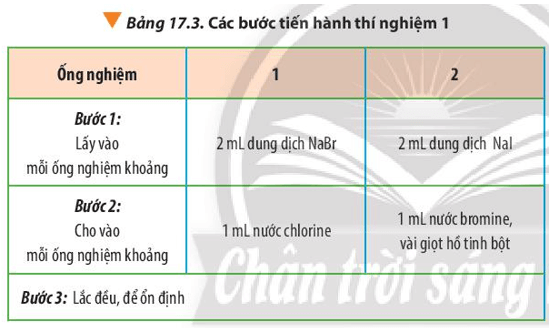
Lời giải:
Hiện tượng:
- Ống nghiệm 1: Dung dịch từ không màu chuyển sang màu vàng.
- Ống nghiệm 2: Dung dịch không màu chuyển thành màu vàng, có hơi màu tím thoát ra. Khi cho thêm hồ tinh bột vào thấy dung dịch chuyển sang màu xanh tím.

Lời giải:
Giải thích kết quả thí nghiệm 1:
- Ống nghiệm 1: Dung dịch NaBr không màu của chuyển sang màu vàng của Br2 do có phản ứng.
Cl2 + 2NaBr → 2NaCl + Br2
- Ống nghiệm 2: Dung dịch NaI không màu chuyển thành màu vàng, có hơi màu tím thoát ra. Khi cho thêm hồ tinh bột vào thấy dung dịch chuyển sang màu xanh tím do I2 gặp hồ tinh bột.
Br2 + 2NaI → 2NaBr + I2
Câu hỏi 14 trang 111 Hóa học 10: Tiến hành thí nghiệm 2, quan sát và ghi nhận hiện tượng.
Thí nghiệm 2: Tính tẩy màu của khí chlorine ẩm
Hóa chất: tinh thể potassium permanganate (KMnO4), dung dịch HCl đặc, giấy màu, nước cất.
Dụng cụ: ống nghiệm 2 nhánh, nút cao su, giá đỡ, thìa thủy tinh, ống hút nhỏ giọt.
Tiến hành:
Bước 1: Dùng thìa thủy tinh lấy một ít tinh thể KMnO4, cho vào nhánh dài của ống nghiệm. Dùng ống hút nhỏ giọt lấy khoảng 1 mL dung dịch HCl đặc cho vào nhánh ngắn của ống nghiệm. Lắp dụng cụ để điều chế khí Cl2 ẩm như Hình 17.4.
Lưu ý: Kiểm tra nút cao su phải được đậy kín trước khi thực hiện bước 2.
Bước 2: Nghiêng ống nghiệm sao cho dung dịch HCl tiếp xúc với KMnO4.
Phương trình hóa học của phản ứng điều chế khí Cl2:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
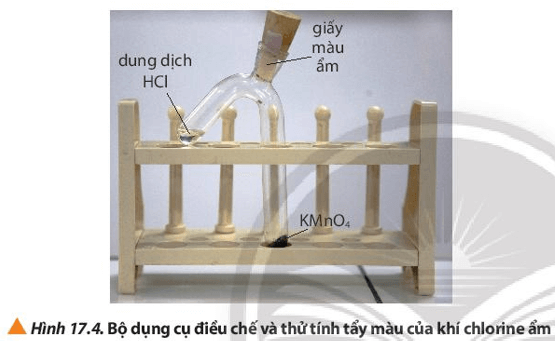
Lời giải:
Hiện tượng: KMnO4 tan trong HCl và KMnO4 bị mất màu. Có khí màu vàng lục thoát ra làm giấy màu ẩm bị mất màu.
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 2 trang 106 Hóa học 10: Hãy kể tên một số chất chứa nguyên tố halogen...
Câu hỏi 12 trang 111 Hóa học 10: Tiến hành thí nghiệm 1, quan sát và ghi nhận hiện tượng...
Câu hỏi 14 trang 111 Hóa học 10: Tiến hành thí nghiệm 2, quan sát và ghi nhận hiện tượng...
Luyện tập trang 112 Hóa học 10: Viết phương trình hóa học của các phản ứng sau...
Câu hỏi 16 trang 113 Hóa học 10: Nhận xét vai trò của halogen trong đời sống, sản xuất và y tế...
Câu hỏi 17 trang 113 Hóa học 10: Tìm hiểu thêm những ứng dụng khác của halogen trong thực tế...
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 16: Các yếu tố ảnh hướng đến tốc độ phản ứng hoá học
Bài 18: Hydrogen halide và một số phản ứng của ion halide
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.