Với giải Câu hỏi trang 23 SGK Hoá học10 Cánh Diều Bài 4: Mô hình nguyên tử và orbital nguyên tử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Nội dung bài viết
Hoá học 10 Cánh Diều trang 23 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Phương pháp giải:
Xác suất tìm thấy electron trong đám mây là khoảng 90%, nghĩa là electron chuyển động khắp nơi trong không gian xung quanh hạt nhân nguyên tử, nhưng tập trung phần lớn ở khu vực này.
Lời giải:
Xác suất tìm thấy electron trong toàn phần không gian bên ngoài đám mây là khoảng 10%
II. Orbital nguyên tử
Phương pháp giải:
- Orbital nguyên tử (AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
- Các electron chuyển động rất nhanh và sự chuyển động này tạo nên hình ảnh giống một đám mây electron.
Lời giải:
Khái niệm AO xuất phát từ mô hình hiện đại nguyên tử.
Câu hỏi 4 trang 23 Hoá học 10: Chọn phát biểu đúng về electron s.
A. Là electron chuyển động chủ yếu trong khu vực không gian hình cầu.
B. Là electron chỉ chuyển động trên một mặt cầu.
C. Là electron chỉ chuyển động trên một đường tròn.
Phương pháp giải:
Electron s hay gọi là AO s là AO hình cầu.
Lời giải:
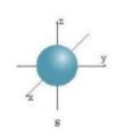
Đáp án đúng: A.
Xem thêm các bài giải Hóa học lớp 10 Cánh Diều hay, chi tiết khác:
Câu hỏi 4 trang 23 Hoá học 10: Chọn phát biểu đúng về electron s...
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Bài 5: Lớp, phân lớp và cấu hình electron
Bài 6: Cấu tạo bảng tuần hoàn các nguyên tố hoá học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.