Với giải Câu hỏi trang 75 SGK Hoá học10 Cánh Diều Bài 13: Phản ứng oxi hoá - khử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Cánh Diều trang 75 Bài 13: Phản ứng oxi hoá - khử
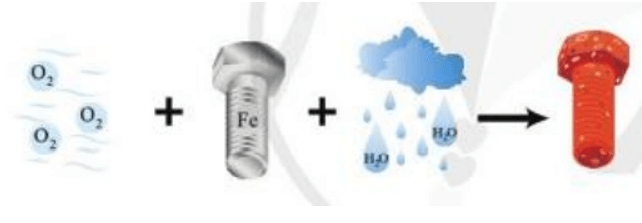
Vận dụng trang 75 Hóa học 10: Sắt bị gỉ trong không khí ẩm. Đó có phải là phản ứng oxi hóa – khử không? Đề xuất một vài biện pháp hạn chế sự tạo gỉ kim loại nêu trên.
Lời giải:
Sắt bị gỉ trong không khí ẩm là phản ứng oxi hóa khử. Các quá trình diễn ra như sau:
Fe nhường electron tạo thành cation Fe2+
Quá trình oxi hóa: Fe → Fe2+ + 2e
Oxi của không khí nhận electron:
Quá trình khử: 2H2O + O2 + 4e → 4OH-
Fe2+ tan vào dung dịch có hòa tan khí O2. Tại đây, Fe2+ tiếp tục bị oxi hóa, dưới tác dụng của ion OH- tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O (oxit sắt(III) ngậm n phân tử nước).
4Fe + 3O2 + nH2O 2Fe2O3.nH2O
Một số biện pháp hạn chế sự tạo gỉ kim loại:
- Ngăn không cho kim loại tiếp xúc với môi trường: Sơn, mạ, bôi dầu mỡ lên trên bề mặt kim loại,…
- Chế tạo hợp kim ít bị ăn mòn: Ví dụ như thép không gỉ (inox) để làm các vật dụng, máy móc …
Câu hỏi 8 trang 75 Hóa học 10: Hãy viết các quá trình thay đổi số oxi hóa của mỗi nguyên tử nguyên tố trong phản ứng oxi hóa hoàn toàn methane (thành phần chính của khí thiên nhiên).
Lời giải:
Phản ứng oxi hóa hoàn toàn methane:
CH4 + O2 CO2 + H2O
⇒
CH4 + 2O2 CO2 + 2H2O
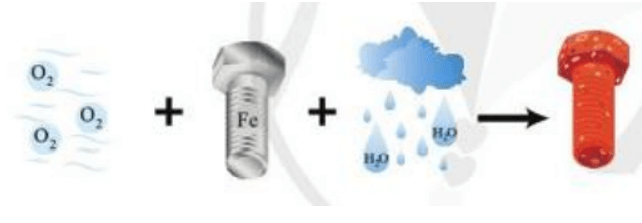
Vận dụng trang 75 Hóa học 10: Sắt bị gỉ trong không khí ẩm. Đó có phải là phản ứng oxi hóa – khử không? Đề xuất một vài biện pháp hạn chế sự tạo gỉ kim loại nêu trên.
Lời giải:
Sắt bị gỉ trong không khí ẩm là phản ứng oxi hóa khử. Các quá trình diễn ra như sau:
Fe nhường electron tạo thành cation Fe2+
Quá trình oxi hóa: Fe → Fe2+ + 2e
Oxi của không khí nhận electron:
Quá trình khử: 2H2O + O2 + 4e → 4OH-
Fe2+ tan vào dung dịch có hòa tan khí O2. Tại đây, Fe2+ tiếp tục bị oxi hóa, dưới tác dụng của ion OH- tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O (oxit sắt(III) ngậm n phân tử nước).
4Fe + 3O2 + nH2O 2Fe2O3.nH2O
Một số biện pháp hạn chế sự tạo gỉ kim loại:
- Ngăn không cho kim loại tiếp xúc với môi trường: Sơn, mạ, bôi dầu mỡ lên trên bề mặt kim loại,…
- Chế tạo hợp kim ít bị ăn mòn: Ví dụ như thép không gỉ (inox) để làm các vật dụng, máy móc …
Xem thêm các bài giải Hóa học lớp 10 Cánh Diều hay, chi tiết khác:
Mở đầu trang 70 Hóa học 10: Quá trình bị gỉ của đinh ốc ngoài không khí được mô tả như hình dưới đây: Trong quá trình này...
Luyện tập 1 trang 71 Hóa học 10: Xác định số oxi hóa của mỗi nguyên tử nguyên tố trong các hợp chất ion Al2O3, CaF2...
Luyện tập 2 trang 71 Hóa học 10: Xác định số oxi hóa của mỗi nguyên tử trong hợp chất sau: NO, CH4...
Câu hỏi 1 trang 71 Hóa học 10: Dựa theo quy tắc octet, giải thích vì sao số oxi hóa của O là -2, của kim loại nhóm IA là +1, của kim loại nhóm IIA là +2 và của Al là +3...
Luyện tập 3 trang 72 Hóa học 10: Xác định số oxi hóa của mỗi nguyên tử trong các hợp chất: Fe2O3, Na2CO3, KAl(SO4)2...
Luyện tập 4 trang 72 Hóa học 10: Xác định số oxi hóa của mỗi nguyên tử trong các ion NO3-, NH4+, MnO4-...
Luyện tập 5 trang 72 Hóa học 10: Xác định số oxi hóa của mỗi nguyên tử trong NH3 theo cách 2...
Câu hỏi 2 trang 72 Hóa học 10: Dựa vào độ âm điện, giải thích vì sao công thức ion giả định của OF2 là F-O2+F- mà không phải là F+O2-F+...
Câu hỏi 3 trang 73 Hóa học 10: Xác định số oxi hóa của các nguyên tử trong phản ứng (1), (2). Cho biết nguyên tố nào có sự thay đổi số oxi hóa...
Câu hỏi 4 trang 73 Hóa học 10: Nguyên tố Cl thể hiện bao nhiêu số oxi hóa trong phản ứng (3)?...
Câu hỏi 5 trang 74 Hóa học 10: Trong phản ứng ở ví dụ 1, hãy chỉ ra chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa...
Câu hỏi 6 trang 74 Hóa học 10: Cân bằng các phản ứng oxi hóa – khử sau. Chỉ ra chất oxi hóa, chất khử, sự oxi hóa, sự khử...
Câu hỏi 7 trang 74 Hóa học 10: Các phản ứng trên thường gặp trong đời sống và trong sản xuất. Những phản ứng này thường diễn ra trong quá trình nào?...
Luyện tập 6 trang 74 Hóa học 10: Cân bằng các phản ứng oxi hóa – khử sau: a) HCl + PbO2 → PbCl2 + Cl2 + H2O...
Vận dụng trang 75 Hóa học 10: Sắt bị gỉ trong không khí ẩm. Đó có phải là phản ứng oxi hóa – khử không? Đề xuất một vài biện pháp hạn chế sự tạo gỉ kim loại nêu trên...
Câu hỏi 8 trang 75 Hóa học 10: Hãy viết các quá trình thay đổi số oxi hóa của mỗi nguyên tử nguyên tố trong phản ứng oxi hóa hoàn toàn methane (thành phần chính của khí thiên nhiên)...
Vận dụng trang 75 Hóa học 10: Sắt bị gỉ trong không khí ẩm. Đó có phải là phản ứng oxi hóa – khử không? Đề xuất một vài biện pháp hạn chế sự tạo gỉ kim loại nêu trên...
Bài 1 trang 76 Hóa học 10: Xác định số oxi hóa của mỗi nguyên tử trong phân tử và ion sau đây...
Bài 2 trang 76 Hóa học 10: Xác định chất oxi hóa, chất khử, viết quá trình oxi hóa, quá trình khử trong các phản ứng sau...
Bài 3 trang 76 Hóa học 10: Cân bằng các phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron...
Bài 4 trang 76 Hóa học 10: Nước oxi già có tính oxi hóa mạnh, do khả năng oxi hóa của hydrogen peroxide (H2O2)...
Bài 5 trang 76 Hóa học 10: Xăng E5 được tạo nên bởi sự pha trộn xăng A92 và ethanol (C2H5OH) theo tỉ lệ thể tích tương ứng là 95 : 5...
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Bài 14: Phản ứng hoá học học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hoá học
Bài 16: Tốc độ phản ứng
Bài 17: Nguyên tố đơn chất halogen
