Với giải Câu hỏi trang 56 SBT Hoá học10 Kết nối tri thức Bài 19: Tốc độ phản ứng giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập SBT Hoá học 10. Mời các bạn đón xem:
Nội dung bài viết
SBT Hoá học 10 Kết nối tri thức trang 56 Bài 19: Tốc độ phản ứng
Bài 19.16 trang 56 SBT Hóa học 10: Thực hiện hai thí nghiệm của cùng một lượng CaCO3 với dung dịch HCl (dư) có nồng độ khác nhau. Thể tích khí CO2 thoát ra theo thời gian được ghi lại trên đồ thị sau:
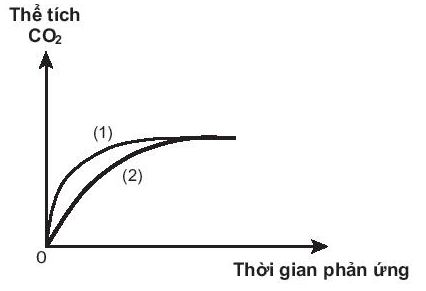
Phản ứng nào đã dùng HCl với nồng độ cao hơn?
Lời giải:
- Phản ứng (1) đã dùng HCl với nồng độ cao hơn vì thể tích khí CO2 thoát ra nhiều hơn trong cùng một khoảng thời gian so với phản ứng (2)
Bài 19.17 trang 56 SBT Hóa học 10: Cho phân ứng hóa học sau:
H2O2 → H2O + O2
Biết rằng tốc độ của phản ứng này tuân theo biểu thức của định luật tác dụng khối lượng.
a) Hãy viết biểu thực tốc độ phản ứng.
b) Tốc độ phản ứng tức thời tăng dần hay giảm dần theo thời gian.
Phương pháp giải:
Dựa vào biểu thức tốc độ tức thời của phản ứng
aA + bB → cC + dD là v=k.CaA.CbB
Lời giải:
a) Biểu thức tốc độ phản ứng: v=k.CH2O2
b) Theo thời gian, nồng độ H2O2 giảm dần → tốc độ phản ứng giảm dần
Bài 19.18 trang 56 SBT Hóa học 10: Cách nào sau đây sẽ làm củ khoai tây chín nhanh nhất?
A. Luộc trong nước sôi.
B. Hấp cách thuỷ trong nồi cơm.
C. Nướng ở 180 °C.
D. Hấp trên nồi hơi.
Phương pháp giải:
Dựa vào nhiệt độ càng cao thì củ khoai tây chín càng nhanh
Lời giải:
- Đáp án: C
Bài 19.19 trang 56 SBT Hóa học 10: Các nhà khảo cổ thường tìm được xác các loài động thực vật thời tiền sử nguyên vẹn trong băng. Hãy giải thích tại sao băng lại giúp bảo quản xác động thực vật.
Phương pháp giải:
Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
Lời giải:
- Ở nhiệt độ thấp, tốc độ của phản ứng giảm " xác các loài động thực vật thời tiền sử nguyên vẹn trong băng
Bài 19.20 trang 56 SBT Hóa học 10: NOCl là chất khí độc, sinh ra do sự phân huỷ nước cường toan (hỗn hợp HNO3 và HCl có tỉ lệ mol 1 : 3). NOCl có tính oxi hoá mạnh, ở nhiệt độ cao bị phân huỷ theo phản ứng hoá học sau:
2NOCl →2NO + Cl2
Tốc độ phản ứng ở 70 °C là 2.10-7 mol/(L.s) và ở 80 °C là 4,5.10-7 mol/(L.s). a) Tính hệ số nhiệt độ γ của phản ứng.
b) Dự đoán tốc độ phản ứng ở 60 °C.
Phương pháp giải:
Dựa vào biểu thức tính hệ số nhiệt độ γ của phản ứng
γ=VT+10VT
Trong đó:
+ VT là tốc độ phản ứng tại nhiệt độ T
+ VT + 10 là tốc độ phản ứng tại nhiệt độ T + 10
Lời giải:
a) Hệ số nhiệt độ γ của phản ứng là γ=V80V70=4,5.10−72.10−7=2,25
b) Tốc độ phản ứng ở 60 oC là V60=V70γ=2.10−72,25=8,889.10−8(mol/L.s)
Phương pháp giải:
Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
Lời giải:
- Đường kính có kích thước hạt nhỏ hơn đường phèn → diện tích tiếp xúc lớn hơn → Phản ứng xảy ra nhanh hơn
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 19.1 trang 53 SBT Hóa học 10: Cho phản ứng xảy ra trong pha khí sau: H2 + Cl2 -> 2HCl...
Bài 19.3 trang 53 SBT Hóa học 10: Sục khí CO2 vào bình chứa dung dịch Na2CO3...
Bài 19.4 trang 54 SBT Hóa học 10: Cho các phản ứng hoá học sau: a) Fe3O4(s) + 4CO(g) → 3Fe(s) + 4CO2(g)...
Bài 19.6 trang 54 SBT Hóa học 10: Cho phản ứng hoá học xảy ra trong pha khí sau: N2 + 3H2 → 2NH3...
Bài 19.7 trang 54 SBT Hóa học 10: Cho bột magnesium vào nước, phản ứng xảy ra rất chậm....
Bài 19.8 trang 54 SBT Hóa học 10: Cho phản ứng hóa học sau: Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)...
Bài 19.9 trang 54 SBT Hóa học 10: Phát biểu nào sau đây là đúng về xúc tác?...
Bài 19.10 trang 55 SBT Hóa học 10: Cho phản ứng thuỷ phân tinh bột có xúc tác là HCl....
Bài 19.11 trang 55 SBT Hóa học 10: Cho các phản ứng hoá học sau: (1) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl...
Bài 19.14 trang 55 SBT Hóa học 10: Xét phản ứng: 3O2 → 2O3...
Bài 19.15 trang 55 SBT Hóa học 10: Cho các phản ứng hoá học sau: a) CH3COOC2H5(l) + H2O(l) → CH3COOH(l) + C2H5OH(l)...
Bài 19.17 trang 56 SBT Hóa học 10: Cho phân ứng hóa học sau: H2O2 → H2O + O2...
Bài 19.18 trang 56 SBT Hóa học 10: Cách nào sau đây sẽ làm củ khoai tây chín nhanh nhất?...
Bài 19.25 trang 57 SBT Hóa học 10: Thực hiện phản ứng sau: CaCO3 + 2HCl → CaCl + CO2↑ + H2O...
Bài 19.26 trang 58 SBT Hóa học 10: Thực hiện phản ứng sau: H2SO4 + Na2S2O3 →Na2SO4 + SO2 + S + H2O...
Bài 19.27 trang 58 SBT Hóa học 10: Đề bài: Xét phản ứng sau: 2ClO2 + 2NaOH → NaClO3 + NaClO2 + H2O...
Bài 19.29 trang 59 SBT Hóa học 10: Thực hiện phản ứng 2ICl + H2 → I2 + 2HCl...
Bài 19.31 trang 60 SBT Hóa học 10: Cho phản ứng hoá học sau: Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)...
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.