Với giải Câu hỏi trang 57 SBT Hoá học10 Kết nối tri thức Bài 19: Tốc độ phản ứng giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập SBT Hoá học 10. Mời các bạn đón xem:
SBT Hoá học 10 Kết nối tri thức trang 57 Bài 19: Tốc độ phản ứng
Bài 19.22 trang 57 SBT Hóa học 10: Khi dùng MnO2 làm xúc tác trong phản ứng phân huỷ H2O2, tại sao ta cần dùng MnO2 ở dạng bột chứ không dùng ở dạng viên.
Phương pháp giải:
Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
Lời giải:
- MnO2 ở dạng bột có kích thước nhỏ hơn MnO2 ở dạng viên → diện tích tiếp xúc lớn hơn → Phản ứng xảy ra nhanh hơn
Bài 19.23 trang 57 SBT Hóa học 10: Trong công nghiệp, vôi sống được sản xuất bằng cách nung đá vôi. Phản ứng hoá học xảy ra như sau:
CaCO3 → CaO + CO2
Khi nung, đá vôi cần phải được đập nhỏ nhưng không nên nghiền mịn đá vôi thành bột. Giải thích.
Phương pháp giải:
Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
Lời giải:
- CaO ở dạng bột có kích thước nhỏ hơn CaO ở dạng viên → diện tích tiếp xúc lớn hơn → Phản ứng xảy ra nhanh hơn
Bài 19.24 trang 57 SBT Hóa học 10: Trong quá trình tổng hợp nitric acid, có giai đoạn đốt cháy NH3 bằng O2 có xúc tác. Phản ứng xảy ra trong pha khí như sau:
4NH3 + 5O2 → 4NO + 6H2O
Trong một thí nghiệm, cho vào bình phản ứng (bình kín) 560 mL khí NH3 và 672 mL khí O2 (có xúc tác, các thể tích khí đo ở đktc). Sau khi thực hiện phản ứng 2,5 giờ, thấy có 0,432 g nước tạo thành.
a) Viết biểu thức tính tốc độ trung bình của phản ứng theo các chất tham gia và chất tạo thành trong phản ứng.
b) Tính tốc độ trung bình của phản ứng theo đơn vị mol/h.
c) Tính số mol NH3 và O2 sau 2,5 giờ.
Phương pháp giải:
Dựa vào biểu thức tốc độ trung bình của phản ứng:
aA + bB → cC + dD là
Lời giải:
a) - Có phản ứng: 4NH3 + 5O2 → 4NO + 6H2O
→ Tốc độ phản ứng trung bình là:
b) Trong bình kín, tỉ lệ về nồng độ chính là tỉ lệ về số mol.
→ Tốc độ phản ứng trung bình là:
- Có mol
→ Tốc độ phản ứng trung bình là:
c) - Có mol và mol
- Có " mol
- Có " mol
Bài 19.25 trang 57 SBT Hóa học 10: Thực hiện phản ứng sau: CaCO3 + 2HCl → CaCl + CO2 + H2O
Theo dõi thể tích CO2 thoát ra theo thời gian, thu được đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).
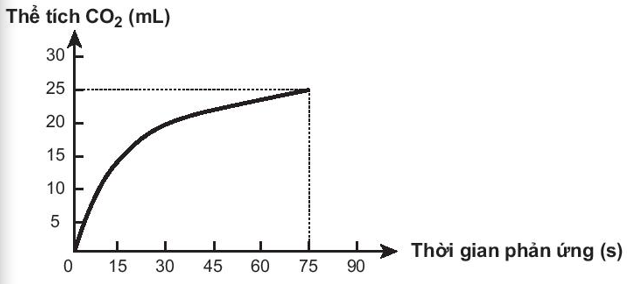
Trong các phát biểu sau, phát biểu nào không đúng?
A. Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
B. Tốc độ phản ứng giảm dần theo thời gian.
C. Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 0,33 mL/s.
D. Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là như nhau.
Lời giải:
- Đáp án: D
- Giải thích:
+ A. Phản ứng đã kết thúc ở giây thứ 75 → Sau giây thứ 75 thì tốc độ phản ứng = 9
+ B. Tốc độ phản ứng giảm dần theo thời gian do nồng độ chất tham gia giảm dần theo thời gian
+ C. Dựa vào phản ứng: CaCO3 + 2HCl → CaCl + CO2# + H2O
->
+ D. Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là khác nhau
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 19.1 trang 53 SBT Hóa học 10: Cho phản ứng xảy ra trong pha khí sau: H2 + Cl2 -> 2HCl...
Bài 19.3 trang 53 SBT Hóa học 10: Sục khí CO2 vào bình chứa dung dịch Na2CO3...
Bài 19.4 trang 54 SBT Hóa học 10: Cho các phản ứng hoá học sau: a) Fe3O4(s) + 4CO(g) → 3Fe(s) + 4CO2(g)...
Bài 19.6 trang 54 SBT Hóa học 10: Cho phản ứng hoá học xảy ra trong pha khí sau: N2 + 3H2 → 2NH3...
Bài 19.7 trang 54 SBT Hóa học 10: Cho bột magnesium vào nước, phản ứng xảy ra rất chậm....
Bài 19.8 trang 54 SBT Hóa học 10: Cho phản ứng hóa học sau: Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)...
Bài 19.9 trang 54 SBT Hóa học 10: Phát biểu nào sau đây là đúng về xúc tác?...
Bài 19.10 trang 55 SBT Hóa học 10: Cho phản ứng thuỷ phân tinh bột có xúc tác là HCl....
Bài 19.11 trang 55 SBT Hóa học 10: Cho các phản ứng hoá học sau: (1) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl...
Bài 19.14 trang 55 SBT Hóa học 10: Xét phản ứng: 3O2 → 2O3...
Bài 19.15 trang 55 SBT Hóa học 10: Cho các phản ứng hoá học sau: a) CH3COOC2H5(l) + H2O(l) → CH3COOH(l) + C2H5OH(l)...
Bài 19.17 trang 56 SBT Hóa học 10: Cho phân ứng hóa học sau: H2O2 → H2O + O2...
Bài 19.18 trang 56 SBT Hóa học 10: Cách nào sau đây sẽ làm củ khoai tây chín nhanh nhất?...
Bài 19.25 trang 57 SBT Hóa học 10: Thực hiện phản ứng sau: CaCO3 + 2HCl → CaCl + CO2 + H2O...
Bài 19.26 trang 58 SBT Hóa học 10: Thực hiện phản ứng sau: H2SO4 + Na2S2O3 →Na2SO4 + SO2 + S + H2O...
Bài 19.27 trang 58 SBT Hóa học 10: Đề bài: Xét phản ứng sau: 2ClO2 + 2NaOH → NaClO3 + NaClO2 + H2O...
Bài 19.29 trang 59 SBT Hóa học 10: Thực hiện phản ứng 2ICl + H2 → I2 + 2HCl...
Bài 19.31 trang 60 SBT Hóa học 10: Cho phản ứng hoá học sau: Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)...
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.