Với giải Câu hỏi trang 60 SBT Hoá học10 Kết nối tri thức Bài 19: Tốc độ phản ứng giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập SBT Hoá học 10. Mời các bạn đón xem:
Nội dung bài viết
SBT Hoá học 10 Kết nối tri thức trang 60 Bài 19: Tốc độ phản ứng
Bài 19.31 trang 60 SBT Hóa học 10: Cho phản ứng hoá học sau:
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
a) Ở nhiệt độ phòng, đo được sau 1 phút có 7,5 mL khí hydrogen thoát ra. Tính tốc độ trung bình của phản ứng theo hydrogen.
b) Ở nhiệt độ thấp, tốc độ phản ứng là 3 mL/min. Hãy tính xem sau bao lâu thì thu được 7,5 mL khí hydrogen.
Phương pháp giải:
ựa vào biểu thức tốc độ trung bình của phản ứng:
aA + bB → cC + dD là \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\
Lời giải:
- Xét phản ứng: Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
→ Tốc độ phản ứng trung bình là: ¯v=11.ΔCH2Δt=7,51=7,5(mL/min
b) - Thời gian để thu được 7,5 mL hydrogen là:
Bài 19.32 trang 60 SBT Hóa học 10: Khi nhiệt độ phòng là 25 °C, cho 10 g đá vôi (dạng viên) vào cốc đựng 100 g dung dịch HCl loãng và nhanh chóng cho lên một cân điện tử. Đọc giá trị khối lượng cốc tại thời điểm ban đầu và sau 1 phút.
Lặp lại thí nghiệm khi nhiệt độ phòng là 35 °C. Kết quả thí nghiệm được ghi trong bảng sau:
|
STT |
Nhiệt độ (oC) |
Khối lượng cốc (g) |
|
|
Thời điểm đầu |
Sau 1 phút |
||
|
1 |
25 |
235,40 |
235,13 |
|
2 |
35 |
235,78 |
235,21 |
a) Tính hệ số nhiệt độ của phản ứng.
b) Giả sử ban đầu cốc chứa dung dịch HCl và đá vôi có khối lượng 235,40 g. Thực hiện thí nghiệm ở 45 °C. Hỏi sau 1 phút, khối lượng cốc là bao nhiêu (Bỏ qua khối lượng nước bay hơi).
Phương pháp giải:
Dựa vào biểu thức tính hệ số nhiệt độ γ của phản ứng
Trong đó:
+ VT là tốc độ phản ứng tại nhiệt độ T
+ VT + 10 là tốc độ phản ứng tại nhiệt độ T + 10
Lời giải:
a) Xét phương trình: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
x → x → x (mol)
- Tại thời điểm 25 oC
+ Có khối lượng cốc giảm = = 44x = 235,40 - 235,13
→ x = mol "
gam
+ Tốc độ phản ứng ở 25 oC là (g/min)
- Tại thời điểm 35 oC
+ Có khối lượng cốc giảm = = 44x = 235,78 - 235,21
→ x = mol ->
gam
+ Tốc độ phản ứng ở 35 oC là (g/min)
- Hệ số nhiệt độ của phản ứng là
b) - Hệ số nhiệt độ của phản ứng là ->
(g/min)
→ gam -> x =
mol
→ Khối lượng cốc giảm = = 44.0,02756 = 1,21 gam
→ Khối lượng cốc sau 1 phút = 235,40 - 1,21 = 234,19 (gam)
Bài 19.33 trang 60 SBT Hóa học 10: Có hai miếng iron có kích thước giống hệt nhau, một miếng là khối iron đặc (A), một miếng có nhiều lỗ nhỏ li ti bên trong và trên bề mặt (B). Thả hai miếng iron vào hai cốc đựng dung dịch HCl cùng thể tích và nồng độ, theo dõi thể tích khí hydrogen thoát ra theo thời gian. Vẽ đồ thị thể tích khi theo thời gian, thu được hai đô thị sau:
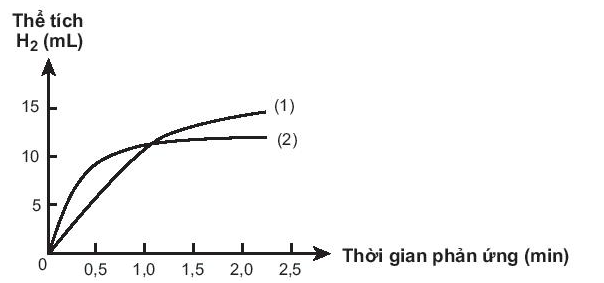
Cho biết đồ thị nào mô tả tốc độ thoát khi từ miếng sắt A, miếng sắt B. Giải thích.
Phương pháp giải:
Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
Lời giải:
- Đồ thị (2) mô tả tốc độ thoát khí từ miếng sắt B vì thể tích khí thoát ra nhiều hơn trong cùng một khoảng thời gian so với đồ thị (1)
- Giải thích: Miếng sắt B có diện tích tiếp xúc lớn hơn -> Tốc độ thoát khí cao hơn
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 19.1 trang 53 SBT Hóa học 10: Cho phản ứng xảy ra trong pha khí sau: H2 + Cl2 -> 2HCl...
Bài 19.3 trang 53 SBT Hóa học 10: Sục khí CO2 vào bình chứa dung dịch Na2CO3...
Bài 19.4 trang 54 SBT Hóa học 10: Cho các phản ứng hoá học sau: a) Fe3O4(s) + 4CO(g) → 3Fe(s) + 4CO2(g)...
Bài 19.6 trang 54 SBT Hóa học 10: Cho phản ứng hoá học xảy ra trong pha khí sau: N2 + 3H2 → 2NH3...
Bài 19.7 trang 54 SBT Hóa học 10: Cho bột magnesium vào nước, phản ứng xảy ra rất chậm....
Bài 19.8 trang 54 SBT Hóa học 10: Cho phản ứng hóa học sau: Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)...
Bài 19.9 trang 54 SBT Hóa học 10: Phát biểu nào sau đây là đúng về xúc tác?...
Bài 19.10 trang 55 SBT Hóa học 10: Cho phản ứng thuỷ phân tinh bột có xúc tác là HCl....
Bài 19.11 trang 55 SBT Hóa học 10: Cho các phản ứng hoá học sau: (1) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl...
Bài 19.14 trang 55 SBT Hóa học 10: Xét phản ứng: 3O2 → 2O3...
Bài 19.15 trang 55 SBT Hóa học 10: Cho các phản ứng hoá học sau: a) CH3COOC2H5(l) + H2O(l) → CH3COOH(l) + C2H5OH(l)...
Bài 19.17 trang 56 SBT Hóa học 10: Cho phân ứng hóa học sau: H2O2 → H2O + O2...
Bài 19.18 trang 56 SBT Hóa học 10: Cách nào sau đây sẽ làm củ khoai tây chín nhanh nhất?...
Bài 19.25 trang 57 SBT Hóa học 10: Thực hiện phản ứng sau: CaCO3 + 2HCl → CaCl + CO2 + H2O...
Bài 19.26 trang 58 SBT Hóa học 10: Thực hiện phản ứng sau: H2SO4 + Na2S2O3 →Na2SO4 + SO2 + S + H2O...
Bài 19.27 trang 58 SBT Hóa học 10: Đề bài: Xét phản ứng sau: 2ClO2 + 2NaOH → NaClO3 + NaClO2 + H2O...
Bài 19.29 trang 59 SBT Hóa học 10: Thực hiện phản ứng 2ICl + H2 → I2 + 2HCl...
Bài 19.31 trang 60 SBT Hóa học 10: Cho phản ứng hoá học sau: Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)...
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.