Với giải Câu hỏi trang 34 Khoa học tự nhiên 7 Cánh diều chi tiết trong Bài 5: Giới thiệu về liên kết hóa học môn Khoa học tự nhiên giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Khoa học tự nhiên 7. Mời các bạn đón xem:
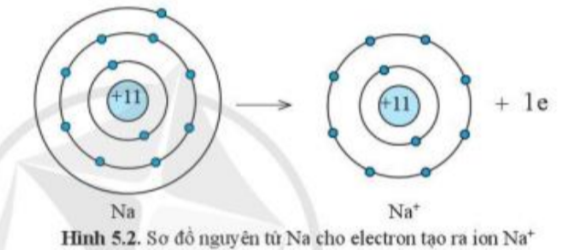
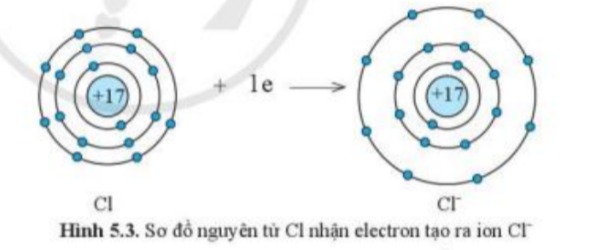
Quan sát hình 5.2 và hình 5.3, cho biết lớp vỏ của các ion Na+, Cl-
Câu hỏi trang 34 KHTN 7
Câu hỏi 2 trang 34 KHTN 7: Quan sát hình 5.2 và hình 5.3, cho biết lớp vỏ của các ion Na+, Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm nào.
Phương pháp giải:
Đếm số electron ở lớp vỏ và số lớp electron của ion Na+, Cl-
Lời giải:
- Xét ion Na+:
+ Có 10 hình cầu màu xanh ở các đường tròn => Có 10 electron ở lớp vỏ
+ Có 2 đường tròn xung quanh hạt nhân => Có 2 lớp electron
=> Lớp vỏ ion Na+ tương tự vỏ nguyên tử của nguyên tố khí hiếm Ne
- Xét ion Cl-
+ Có 18 hình cầu màu xanh ở các đường tròn => Có 18 electron ở lớp vỏ
+ Có 3 đường tròn xung quanh hạt nhân => Có 3 lớp electron
=> Lớp vỏ ion Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm Ar
Câu hỏi 3 trang 34 KHTN 7: Quan sát hình 5.2, hãy so sánh về số electron, số lớp electron giữa nguyên tử Na và ion Na+
Phương pháp giải:
Đếm số electron và số lớp electron của nguyên tử Na, ion Na+
Lời giải:
- Nguyên tử Na có 11 electron và 3 lớp electron
- Ion Na+ có 10 electron và 2 lớp electron
=> Nguyên tử Na đã mất đi 1 electron để tạo thành ion Na+
Xem thêm các bài giải Khoa học tự nhiên 7 Cánh diều hay, chi tiết khác:
Mở đầu trang 33 KHTN 7: Trong điều kiện thường, nguyên tử của các nguyên tố khí hiếm tồn tại độc lập vì có lớp electron ngoài cùng bền vững. Nguyên tử của các nguyên tố khác luôn có xu hướng tham gia liên kết để có được lớp electron ngoài cùng bền vững tương tự khí hiếm. Vậy liên kết giữa các nguyên tử được hình thành như thế nào?
Câu hỏi 1 trang 33 KHTN 7: Quan sát hình 5.1, hãy cho biết số electron ở lớp ngoài cùng của vỏ nguyên tử khí hiếm
Tìm hiểu thêm trang 34 KHTN 7: Helium được phát hiện vào năm 1868, khi các nhà khoa học nhận thấy một nguyên tố chưa được biết đến trong quang phổ ánh sáng từ Mặt Trời. Helium được đặt theo tên của thần Mặt Trời – Helios (theo tiếng Hy Lạp). Tuy nhiên, phải thới năm 1895, các nhà khoa học mới thu được helium trong quá trình xử lí quặng uranium. Mặc dù trong vũ trụ, helium là khí phổ biến thứ hai sau khí hydrogen, nhưng trên Trái Đất khí helium tương đối hiếm. Hãy tìm hiểu một số ứng dụng của helium trong thực tiễn
Luyện tập 1 trang 35 KHTN 7: Số electron ở lớp ngoài cùng của nguyên tử K và F lần lượt là 1 và 7. Hãy cho biết khi K hết hợp với F để tạo thành phân tử potassium fluoride, nguyên tử K cho hay nhận bao nhiêu electron. Vẽ sơ đồ tạo thành liên kết trong phân tử potassium fluoride
Câu hỏi trang 35 KHTN 7
Luyện tập 2 trang 35 KHTN 7: Nguyên tử Ca có 2 electron ở lớp ngoài cùng. Hãy vẽ sơ đồ tạo thành liên kết khi nguyên tử Ca kết hợp với nguyên tử O tạo ra phân tử calcium oxide
Luyện tập 3 trang 36 KHTN 7: Nguyên tử K kết hợp với nguyên tử Cl tạo thành phân tử potassium chloride. Theo em, ở điều kiện thường, potassium chloride là chất rắn, chất lỏng hay chất khí? Vì sao?
Câu hỏi 6 trang 36 KHTN 7: Quan sát hình 5.9, hãy cho biết nguyên tử H trong phân tử hydrogen có lớp vỏ tương tự khí hiếm nào
Luyện tập 4 trang 36 KHTN 7: Hai nguyên tử Cl liên kết với nhau tạo thành phân tử chlorine
Câu hỏi 7 trang 37 KHTN 7: Quan sát hình 5.10, cho biết trong phân tử nước, mỗi nguyên tử H và O có bao nhiêu electron ở lớp ngoài cùng
Luyện tập trang 37 KHTN 7
Câu hỏi 8 trang 37 KHTN 7: Quan sát hình 5.11, hãy cho biết trong phân tử khí carbonic, nguyên tử C có bao nhiêu electron dùng chung với nguyên tử O
Luyện tập 7 trang 37 KHTN 7: Hai nguyên tử N kết hợp với nhau tạo thành phân tử nitrogen. Hãy vẽ sơ đồ tạo thành liên kết trong phân tử nitrogen
Vận dụng trang 38 KHTN 7: Hãy giải thích các hiện tượng sau:
Câu hỏi 9 trang 38 KHTN : So sánh một số tính chất chung của chất cộng hóa trị với chất ion