Toptailieu.vn biên soạn và giới thiệu Phương pháp giải Các dạng bài tập dòng điện trong chất điện phân (50 bài tập minh họa) hay, chi tiết nhất, từ cơ bản đến nâng cao giúp học sinh nắm vững kiến thức, từ đó học tốt môn Vật lí 11.
Phương pháp giải Các dạng bài tập dòng điện trong chất điện phân (50 bài tập minh họa)
I. Lý thuyết
1. Dòng điện trong chất điện phân
- Các dung dịch muối, axit, bazơ, các muối nóng chảy được gọi là các chất điện phân.
- Thuyết điện li: Trong dung dịch, các axit, bazơ và muối bị phân li thành ion: Anion mang điện âm là gốc axit hoặc nhóm (OH), còn cation mang điện dương là ion kim loại, ion H+ hoặc một số nhóm nguyên tử khác.
- Dòng điện trong chất điện phân là dòng chuyển dời có hướng của các ion trong điện trường (các ion dương theo chiều điện trường và các ion âm ngược chiều điện trường).
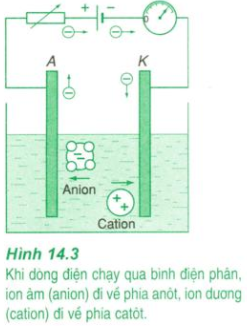
- Khi đến các điện cực thì các ion sẽ trao đổi êlectron với các điện cực rồi được giải phóng ra ở đó, hoặc tham gia các phản ứng phụ. Một trong các phản ứng phụ là phản ứng cực dương tan.
2. Hiện tượng dương cực tan (suất phản điện của bình bằng không)
- Hiện tượng dương cực tan xảy ra khi các anion đi tới anôt kéo các ion kim loại của điện cực vào trong dung dịch.
- Ví dụ: Ở hình 1, bình điện phân dung dịch CuSO4 với điện cực bằng đồng. Khi có dòng điện chạy qua, nguyên tử đồng cở Anôt biến thành ion Cu2+ và tan vào dung dịch. Ion Cu2+ ở gần catôt nhận electron của catôt, biến thành nguyên tử Cu và bám vào điện cực này.
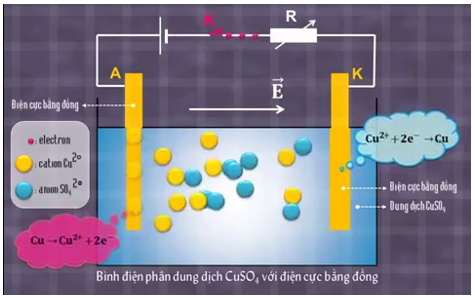
Hình 1 Bình điện phân dung dịch CuSO4 với điện cực bằng đồng
- Trong bình điện phân dương cực tan, điện năng không bị tiêu hao trong các quá trình phân tách các chất mà chỉ bị tiêu hao vì toả nhiệt. Do đó, bình điện phân không khác gì một điện trở. Suất phản điện của bình bằng không.
- Đối với các bình điện phân mà các điện cực làm bằng chất dẫn điện nhưng không tạo thành ion có thể tan vào dung dịch khi điện phân (dương cực không tan). Trong bình điện phân này một phần điện năng dùng để phân tách các chất.
W = Ep. I.t
Trong đó Ep gọi là suất phản điện của bình điện phân, phụ thuộc vào bản chất của điện cực và chất điện phân.
Ví dụ (hình 2): Bình điện phân dung dịch H2SO4 với điện cực bằng graphit. Lúc đầu, trong hai ống nghiệm úp ngược chức đầy dung dịch H2SO4. Khi có dòng điện chạy qua ở anôt có O2 bay lên, còn ở catôt có H2 bay lên, đẩy cột dung dịch tụt xuống.
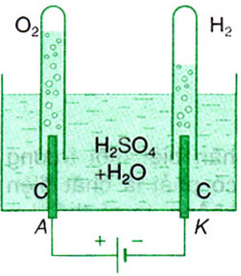
Hình 2. Bình điện phân dung dịch H2SO4 với điện cực bằng graphit
Chú ý: Khi có hiện tượng dương cực tan, dòng điện trong chất điện phân tuân theo định luật Ôm giống như đối với đoạn mạch chỉ có điện trở thuần.
3. Các định luật Fa-ra-đây
* Định luật 1: Khối lượng m của các chất được giải phóng ra ở điện cực của bình điện phân tỉ lệ với điện lượng q chạy qua bình đó.
- Biểu thức: m = k.q
- Trong đó:
+ k là đương lượng điện hóa, k phụ thuộc vào bản chất của chất được giải phóng, k có đơn vị là g/C
+ q là điện lượng chạy qua bình điện phân (C)
+ m là khối lượng của các chất được giải phóng ở điện cực (g)
* Định luật 2: Đương lượng điện hóa k của một nguyên tố tỉ lệ với đương lượng gam của nguyên tố đố. Hệ số tỉ lệ là , trong đó F gọi là số Fa-ra-đây.
- Biểu thức:
Trong đó:
+ A là khối lượng nguyên tử của chất được giải phóng (g)
+ n là hóa trị của chất thoát ra
+ F =96500 C/mol là hằng số Fa-ra-đây (C/mol)
+ k là đương lượng điện hóa (g/C)
* Công thức Fa-ra-đây
- Trong đó:
+ k là đương lượng điện hóa của chất được giả phóng ra ở điện cực (g/C)
+ F = 96 500 C/mol là hằng số Farađây
+ n là hóa trị của chất thoát ra
+ A là khối lượng nguyên tử của chất được giải phóng (g)
+ q là điện lượng dịch chuyển qua bình điện phân (C)
+ I là cường độ dòng điện qua bình điện phân (A)
+ t là thời gian điện phân (s)
+ m là khối lượng chất được giải phóng (g)
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.