Toptailieu.vn biên soạn và giới thiệu Phương pháp giải Công thức hiđroxit cao nhất (50 bài tập minh họa) hay, chi tiết nhất, từ cơ bản đến nâng cao giúp học sinh nắm vững kiến thức, từ đó học tốt môn Hóa học 10.
Phương pháp giải Công thức hiđroxit cao nhất (50 bài tập minh họa)
1. Công thức hiđroxit cao nhất
- Hóa trị cao nhất trong hợp chất với hiđroxit của nguyên tố nhóm A = số thứ tự nhóm.
Giả sử n là số thứ tự nhóm A. Ta có:
+ Nếu R là kim loại (n = 1, 2, 3): Công thức hiđroxit cao nhất là R(OH)n
+ Nếu R là phi kim (n = 4, 5, 6, 7): Từ công thức ban đầu R(OH)n chuyển thành HnROn.
Sau đó tiếp tục trừ đi số nguyên lần phân tử nước (H2O) đến khi công thức tới dạng HROx hoặc H2ROx thì ngưng vì nó không còn dư nước để trừ nữa.
Trừ một số trường hợp đặc biệt như: H3PO4; …
Ví dụ: Cho các nguyên tố cùng thuộc chu kì 3: 11Na, 13Al và 17Cl. Viết công thức hiđroxit cao nhất của các nguyên tố.
Hướng dẫn giải:
+) 11Na (1s22s22p63s1) → Na thuộc chu kì 3, nhóm IA → n = 1
→ Công thức hiđroxit cao nhất là NaOH.
+) 13Al (1s22s22p63s23p1) → Al thuộc chu kì 3, nhóm IIIA → n = 3
→ Công thức hiđroxit cao nhất là Al(OH)3.
+) 17Cl (1s22s22p63s23p5) → Cl thuộc chu kì 3, nhóm VIA → n = 7
Cl(OH)7 H7ClO7 HClO4.3H2O
→ Công thức hiđroxit cao nhất là HClO4
2. Bạn nên biết
- Trong 1 chu kì: từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, tính bazơ của oxit và hiđroxit tương ứng giảm dần, đồng thời tính axit của chúng tăng dần.
|
Nhóm |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
Oxit |
Na2O Oxit bazơ |
MgO Oxit bazơ |
Al2O3 Oxit lưỡng tính |
SiO2 Oxit axit |
P2O5 Oxit axit |
SO3 Oxit Axit |
Cl2O7 Oxit axit |
|
Hidroxit |
NaOH Bazơ mạnh kiềm |
Mg(OH)2 Bazơ yếu |
Al(OH)3 Hiđroxit lưỡng tính |
H2SiO3 Axit yếu |
H3PO4 Axit trung bình |
H2SO4 Axit mạnh |
HClO4 Axit rất mạnh |
|
Bazơ |
Axit |
||||||
- Trong 1 nhóm A : Đi từ trên xuống, theo chiều tăng dần điện tích hạt nhân tính bazơ của các oxit và hiđroxit tăng dần, tính axit giảm dần.
3. Bài tập minh họa

Câu 1: Cho các nguyên tố sau: K( Z =19) , Mg( Z =12), S( Z = 16). Công thức hiđroxit tương ứng là:
A. KOH, MgOH, H2SO4 . B. K(OH)2, MgOH, H2SO4.
C. KOH, Mg(OH)2, H2SO3. D. KOH, Mg(OH)2, H2SO4.
Hướng dẫn:
+) K (Z =19). Cấu hình electron của K là: 1s22s22p63s23p64s1 → K thuộc chu kì 4, nhóm IA.
→ Công thức hiđroxit cao nhất là KOH.
+) Mg (Z =12). Cấu hình electron của Mg là: 1s22s22p63s2 → Mg thuộc chu kì 3, nhóm IIA.
→ Công thức hiđroxit cao nhất là Mg(OH)2.
+) S (Z = 16). Cấu hình electron của S là: 1s22s22p63s23p4 → S thuộc chu kì 3, nhóm VIA.
S(OH)6 <-> H6SO6 <-> H2SO4.2H2O
→ Công thức hiđroxit cao nhất là: H2SO4
→ Chọn D.
Câu 2: Hiđroxit cao nhất của một nguyên tố có dạng HRO4. Biết R cho hợp chất khí với hiđro chứa 2,74%H theo khối lượng. Nguyên tố R là
A. P. B. I. C. Br. D. Cl.
Hướng dẫn
Hiđroxit cao nhất của một nguyên tố có dạng HRO4
Giả sử gọi: n là số thứ tự nhóm A; n = 4, 5, 6, 7.
y là số nguyên lần phân tử nước.
Ta có:
HRO4.yH2O = R(OH)n
Bảo toàn nguyên tố H → 1 +2y = n
Bảo toàn nguyên tố O → 4 + y = n
→ 1 + 2y = 4 + y → y = 3, n = 7
→ R thuộc nhóm VIIA.
%mH = 2,74% = 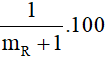
→ mR 35,5 (g/mol) → R là Cl
→ Chọn D
Câu 3: Hợp chất khí với hiđro của một nguyên tố ứng với công thức RH4. Hiđroxit cao nhất của nó chứa 3,226% H (theo khối lượng ). Nguyên tố R là
A. Si B. C C. S D. Ca
Hướng dẫn
Hợp chất khí với hiđro của R là: RH4
→ R thuộc nhóm IVA
→ R(OH)4 <-> H4RO4 <-> H2RO3.H2O
→ Công thức hiđroxit cao nhất có dạng H2RO3
%mH = 3,226% =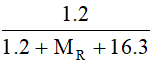 .100
.100
→ MR ≈12 (g/mol) → R là cacbon (C)
→ Chọn B.
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.