Toptailieu.vn biên soạn và giới thiệu Phương pháp giải Các dạng bài toán viết công thức cấu tạo của các phân tử (50 bài tập minh họa) hay, chi tiết nhất, từ cơ bản đến nâng cao giúp học sinh nắm vững kiến thức, từ đó học tốt môn Hóa học 10.
Nội dung bài viết
Phương pháp giải Các dạng bài toán viết công thức cấu tạo của các phân tử (50 bài tập minh họa)
- Viết cấu hình e của các nguyên tử tạo hợp chất
- Tính nhẩm số e mỗi nguyên tử góp chung = 8 – số e lớp ngoài cùng
- Biểu diễn các e lớp ngoài cùng và các cặp e chung (bằng các dấu chấm) lên xung quanh kí hiệu nguyên tử ⇒ công thức electron
- Thay mỗi cặp e chung bằng 1 gạch ngang ta được công thức cấu tạo
Lưu ý:
- Khi hai nguyên tử liên kết mà trong đó có một nguyên tử A đạt cấu hình bền còn nguyên tử B kia chưa thì lúc này A sử dụng cặp electron của nó để cho B dùng chung → hình thành liên kết cho nhận (hay phối trí) biểu diễn bằng → hướng vào nguyên tử nhận cặp electron đó.
- Khi có nhiều nguyên tử đều có thể đưa cặp electron ra cho nguyên tử khác dùng chung thì ưu tiên cho nguyên tử nào có độ âm điện nhỏ hơn.
- Khi viết công thức cấu tạo (CTCT) của:
* Axit có oxi: theo thứ tự
+ Viết có nhóm H – O
+ Cho O của nhóm H – O liên kết với phi kim trung tâm
+ Sau đó cho phi km trung tâm liên kết với O còn lại nếu có.
* Muối:
+ Viết CTCT của axit tương ứng trước.
+ Sau đó thay H ở axit bằng kim loại.
Ví dụ 1. Trình bày sự hình thành liên kết cho nhận trong các phân tử và sau H3O+, HNO3
Lời giải:
- Xét H3O+ ta có
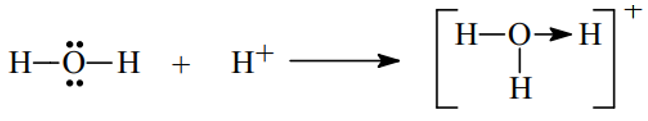
- Xét phân tử HNO3
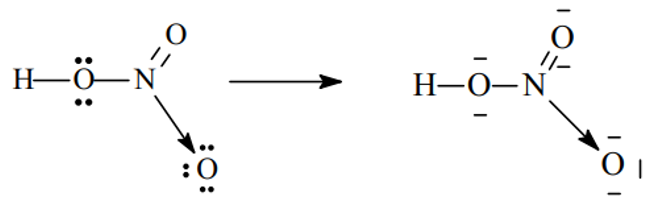
Sau khi hình thành các liên kết cộng hóa trị, N (chứ không phải O) sẽ cho 1 cặp electron đến nguyên tử O thứ ba (đang thiếu 2e để đạt cấu hình khí trơ) hình thành liên kết cho - nhận .
Chú ý:
- Cấu tạo phân tử và biểu diễn với liên kết cho nhận là để phù hợp với quy tắc bát tử.
- Với nguyên tử cho cặp electron có 3 lớp trở lên, có thể có hóa trị lớn hơn 4 nên còn biểu diễn bằng liên kết cộng hóa trị.
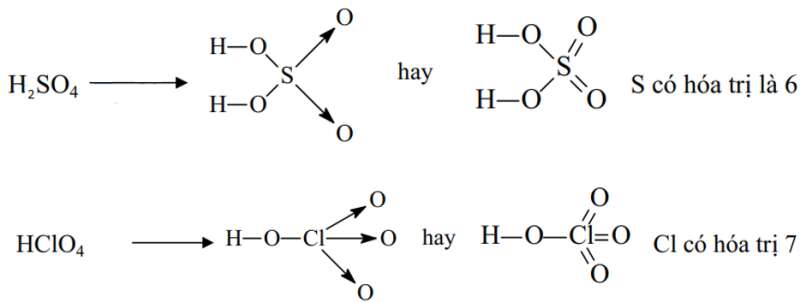
Ví dụ 2: Viết công thức cấu tạo của phân tử H2SO4 và HClO4 để thấy được quy tác bát tử chỉ đúng với 1 số trường hợp
Ví dụ 3: Viết công thức electron và công thức cấu tạo các ion đa nguyên tử sau: CO32-, HCO3-
Lời giải:
Ví dụ 4. Viết công thức cấu tạo của các chất sau
Cl2O, Cl2O5,HClO3.
Lời giải:
Cl2O:
Cl2O5:
HClO3:
Câu 1. Hãy viết công thức electron và công thức cấu tạo của các phân tử sau: PH3, SO2
Lời giải:
Đáp án:
Câu 2. Viết công thức electron, công thức cấu tạo của HClO, HCN, HNO2.
Lời giải:
Đáp án:
Câu 3. Viết công thức cấu tạo của các phân tử và ion sau: H2SO3, Na2SO4, HClO4, CuSO4, NaNO3, CH3COOH, NH4NO3, H4P2O7.
Lời giải:
Đáp án:
Câu 4. Viết công thức electron, công thức cấu tạo của các phân tử:NH3, C2H2, C2H4, CH4, Cl2, HCl, H2O.
Lời giải:
Đáp án:
Câu 5. Viết công thức cấu tạo của các phân tử và ion sau: NH4+, Fe3O4, KMnO4, Cl2O7
Lời giải:
Đáp án:
Câu 6. Viết công thức electron và công thức cấu tạo các chất sau:HNO3, Al(OH)3, K2Cr2O7, N2O5, Al2S3, H2CrO4, PCl5
Lời giải:
Đáp án:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.