Toptailieu.vn biên soạn và giới thiệu Phương pháp giải 50 bài tập về cách nhận biết, tách chất Nhóm Halogen (50 bài tập minh họa) hay, chi tiết nhất, từ cơ bản đến nâng cao giúp học sinh nắm vững kiến thức, từ đó học tốt môn Hóa học 10.
Phương pháp giải 50 bài tập về cách nhận biết, tách chất Nhóm Halogen (50 bài tập minh họa)
Dựa vào các tính chất đặc trưng của chúng
a/ Nhận biết một số anion ( ion âm)
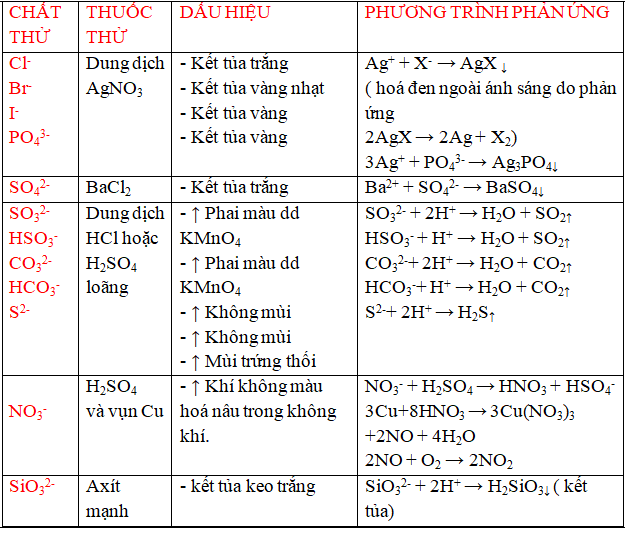
b/ Nhận biết một số chất khí .
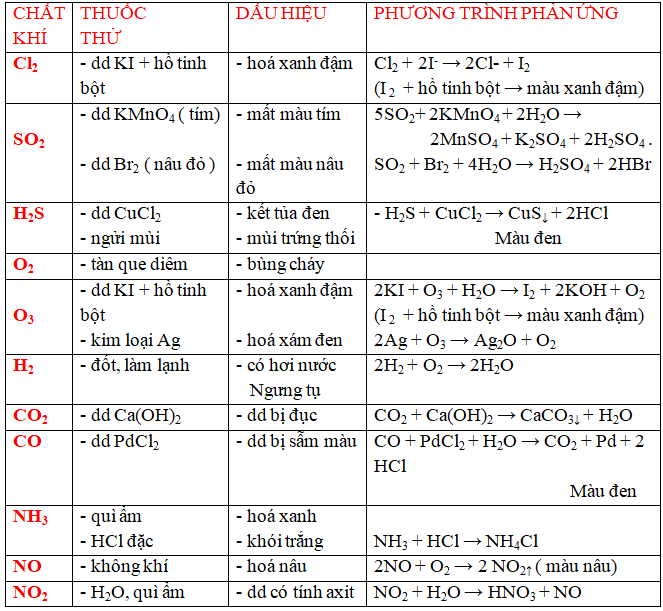
c/ Nhận biết một số chất khí .
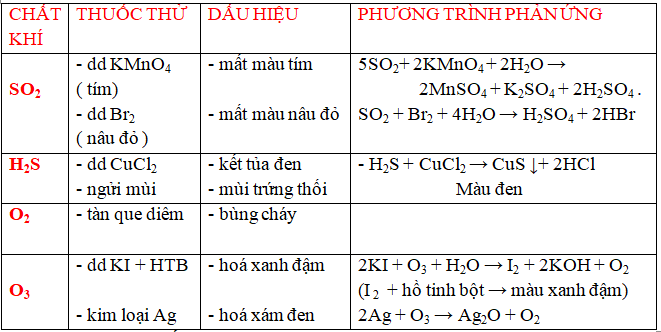
*Với bài tập tách chất
a) Tách một chất ra khỏi hỗn hợp :
Dạng toán này chỉ cần tách riêng một chất ra khỏi hỗn hợp, loại bỏ các chất khác, ta có một trong hai cách giai sau :
- Cách 1: Dùng hóa chất phản ứng tác dụng lên các chất cần loại bỏ, còn chất cần tách riêng không tác dụng sau phản ứng được tách ra dễ dàng.
- Cách 2: Dùng hóa chất tác dụng với chất cần muốn tách riêng tạo ra phẩm mới. Sản phẩm dễ tách khỏi hỗn hợp và dễ tái tạo lại chất đầu.
b) Tách riêng các chất ra khỏi nhau :
Dạng toán này tách riêng các chất ra khỏi nhau không được bỏ chất nào. Để giải ta sử dụng đồng thời cách 1, cách 2 ở trên để giải.
Ví dụ 1. Chỉ dùng một hóa chất, trình bày phương pháp nhận biết các dung dịch sau: KI, Zn(NO3 ) 2 , Na2 CO3 , AgNO3 , BaCl2
Lời giải:
Trích mỗi dung dịch một ít làm mẫu thử:
Cho dung dịch HCl lần lượt vào các mẫu thử trên.
- Mẫu thử tạo hiện tượng sùi bọt khí là Na2CO3
2HCl + Na2 CO3 → 2NaCl + CO2 + H2 O
- Mẫu thử tọa kết tủa trắng là AgNO3
AgNO3 + HCl → AgCl↓+ HNO3
Cho dung dịch AgNO3 lần lượt vào hai mẫu thử còn lại
- Mẫu thử nào kết tủa trắng là dung dịch BaCl2
2AgNO3 + BaCl2 → 2AgCl↓ + Ba(NO3 ) 2
- Mẫu thử tạo kết tủa vàng là dung dịch KI
AgNO2 + KI → AgI ↓ (vàng) + KNO3
- Mẫu thử không có hiện tượng gì là dung dịch Zn(NO3 ) 2
Ví dụ 2. Bằng phương pháp hóa học, hãy phân biệt các ung dịch đựng trong các lọ mất nhãn như sau: NaF, NaCl, NaBr, và NaI.
Lời giải:
Trích mỗi dung dịch một ít làm mẫu thử:
Cho dung dịch AgNO3 lần lượt vào các mẫu thử trên.Mẫu thử nào trong suốt là NaF. Vì AgF tan tốt.
- Mẫu thử tạo kết tủa trắng là NaCl
AgNO3 + NaCl → AgCl↓ + NaNO3
- Mẫu thử tạo kết tủa vàng nhạt là NaBr
AgNO3 + NaBr → AgBr↓ + NaNO3
- Mẫu thử tọa kết tủa vàng đậm là NaI
AgNO3 + NaI → AgI↓ + NaNO3
Ví dụ 3: . Bằng phương pháp hóa học. Hãy nhận biết các dung dịch đựng trong các lọ mất nhãn: NaCl, NaBr, NaI, HCl, H2 SO4 , KOH
Lời giải:
Trích mỗi dung dịch một ít làm mẫu thử:
Cho quỳ tím lần lượt vào các mẫu thử. Ta chia thành 3 nhóm hóa chất sau:
Nhóm I: Dung dịch làm quỳ tím hóa xanh: KOH
Nhóm II: Dung dịch làm quỳ tím hóa đỏ: HCl, H2 SO4 .
Nhóm III: Dung dịch không đổi màu quỳ tím: NaI, NaCl, NaBr
Cho dung dịch AgNO3 lần lượt vào các mẫu thử ở nhóm (III)
- Mẫu thử tạo kết tủa trắng là NaCl
AgNO3 + NaCl → AgCl↓ + NaNO3
- Mẫu thử tạo kết tủa vàng nhạt là NaBr
AgNO3 + NaBr → AgBr↓+ NaNO3
- Mẫu thử tọa kết tủa vàng đậm là NaI
AgNO3 + NaI → AgI↓+ NaNO3
Cho dung dịch AgNO3 lần lượt vào các mẫu thử ở nhóm (II)
- Mẫu thử nào kết tủa trắng là HCl
AgNO3 + HCl → AgCl↓ + HNO3
- Còn lại là H2 SO4
Ví dụ 4: Không dùng thuốc thử nào khác, hãy nhận biết các dung dịch: MgCl2 , NaOH, NH4 Cl, BaCl2 , H2 SO4
Lời giải:
Ghi số thứ tự 1, 2, 3, 4, 5, trên 5 lọ dung dịch cần nhận biết. Rót dung dịch ở mỗi lọ vào lần lượt các ống nghiệm đã được đánh cùng số. Nhỏ 1 dung dịch vào mẫu thử của 4 dung dịch còn lại. Sau các lần thí nghiệm cho đến khi hoàn tất ta được kết quả sau đây:
Từ bảng kết quả nhận thấy:
- Chất nào tác dụng với 4 chất kia tạo thành 1↓ + 1↑ là NaOH
- Chất nào tạo thành khí với NaOH là NH4 Cl; chất tọa thành kết tủa với NaOH và MgCl2
- Chất tác dụng với 4 chất khí tạo thành 1↓ mà khác MgCl2 là BaCl2 và chất tạo thành kết tủa với BaCl2 là H2 SO4
Ví dụ 5. Brom có lẫn một ít tạp chất là clo. Làm thế nào để thu được brom tinh khiết . Viết phương trình hóa học.
Lời giải:
Cho một ít NaBr vào hỗn hợp:
Cl2 + 2NaBr → 2NaCl + Br2
Chưng cất hỗn hợp để lấy Br
Ví dụ 6. Tinh chế N2 trong hỗn hợp khí N2 , CO2 , H2 S
Lời giải:
Cho hỗn hợp khí sục qua dung dịch nước vôi trong có dư, chỉ có khí N2 không tác dụng đi ra khỏi dung dịch, hai khí còn lại phản ứng với nước vôi theo phương trình phản ứng:
CO2 + Ca(OH)2 → CaCO3 ↓ + H2 O
H2 S + Ca(OH) 2 → CaS ↓ + 2H2 O
Câu 1. Có 4 chất bột màu trắng là vôi bột, bột gạo, bột thạch cao (CaSO4.2H2O) bột đá vôi (CaCO3). Chỉ dùng chất nào dưới đây là nhận biết ngay được bột gạo ?
A. Dung dịch HCl. B. Dung dịch H2SO4 loãng.
C. Dung dịch Br2. D. Dung dịch I2.
Lời giải:
Đáp án: D
Cho Iot và dung dịch hồ tinh bột ⇒ dung dịch không màu chuyển thành màu xanh
Câu 2. Để phân biệt 4 dung dịch KCl, HCl, KNO3, HNO3 ta có thể dùng
A. Dung dịch AgNO3. B. Quỳ tím.
C. Quỳ tím và dung dịch AgNO3. D. Đá vôi.
Lời giải:
Đáp án: C
- Dùng quỳ tím nhận biết được 2 nhóm: HCl, HNO3 (nhóm 1) làm quỳ chuyển đỏ và KCl, KNO3 (nhóm 2) không làm quỳ chuyển màu.
- Cho dung dịch AgNO3 lần lượt vào 2 ống nghiệm của mỗi nhóm ⇒ tạo kết tủa trắng là HCl (nhóm 1) và KCl (nhóm 2)
AgNO3 + HCl → AgCl + HNO3
AgNO3 + KCl → AgCl + KNO3
Câu 3. Có thể phân biệt 3 bình khí HCl, Cl2, H2 bằng thuốc thử
A. Dung dịch AgNO3. B. Quỳ tím ẩm.
C. Dung dịch phenolphtalein. D. Không phân biệt được.
Lời giải:
Đáp án: B
HCl làm quỳ tím chuyển đỏ
Cl2 làm mất màu quỳ tím
H2 không làm quỳ tím chuyển màu
Câu 4. Chỉ dùng hóa chất nào sau đây để nhận biết các dung dịch: BaCl2, Zn(NO3)2, Na2CO3, AgNO3, HBr.
A. HCl B. AgNO3 C. Br2 D. Không nhận biết được
Lời giải:
Đáp án: A
Chọn thuốc thử là dung dịch HCl.
Lần lượt nhỏ dung dịch HCl vào các mẫu thử đựng trong 5 ống nghiệm riêng biệt.
- Mẫu thử có sủi bọt khí là Na2CO3
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
- Mẫu thử tạo kết tủa trắng, ra ngoài ánh sáng hóa đen là AgNO3
AgNO3 + HCl → AgCl↓ + HNO3
2AgCl → 2Ag + Cl2
- Mẫu thử còn lại là BaCl2, Zn(NO3)2, HBr không thấy hiện tượng
Dùng AgNO3 vừa nhận biết để nhận ra ba mẫu thử còn lại
- Mẫu thử tạo kết tủa trắng là BaCl2:
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
- Mẫu thử tạo kết tủa vàng nhạt là HBr
HBr + AgNO3 → AgBr↓ + HNO3
- Mẫu thử không hiện tượng là Zn(NO3)2
Câu 5. Brom có lẫn một ít tạp chất là clo. Một trong các hoá chất có thể loại bỏ clo ra khỏi hỗn hợp là :
A. KBr. B. KCl. C. H2O. D. NaOH.
Lời giải:
Đáp án: A
Cl2 + KBr → Br2 + KCl
Câu 6. Dùng thuốc thử thích hợp để nhận biết các dung dịch sau đây: KI, HCl, NaCl, H2SO4
Lời giải:
Đáp án:
- Dùng quỳ tím phân biệt được 2 nhóm: HCl, H2SO4 làm quỳ chuyển đỏ
KI và NaCl không làm đổi màu quỳ tím.
- Dùng dung dịch BaCl2 phân biệt HCl và H2SO4: Sản phẩm tạo kết tủa trắng là H2SO4
BaCl2 + H2SO4 → BaSO4 + 2HCl
- Dùng dung dịch AgNO3 để phân biệt dung dịch KI và NaCl (AgI↓ màu vàng tươi; AgCl↓ màu trắng)
AgNO3 + KI → AgI + KNO3
AgNO3 + NaCl → AgCl + KNO3
Hoặc đốt: KI ngọn lửa màu tím; NaCl ngọn lửa màu vàng.
Câu 7. Có ba bình không ghi nhãn, mỗi bình đựng một trong các dung dịch NaCl, NaBr và NaI. Chỉ dùng hai thuốc thử (không dùng AgNO3), làm thế nào để xác định dung dịch chứa trong mỗi bình ? Viết phương trình hóa học.
Lời giải:
Đáp án:
Dùng nước brom cho lần lượt vào ba dung dịch, nhận ra bình đựng dung dịch NaI nhờ chuyển màu nâu sẫm
Br2 + 2NaI → 2NaBr + I2
- Hai dung dịch còn lại là NaCl và NaBr thì dùng nước clo nhận ra dung dịch NaBr do dung dịch chuyển sang màu vàng.
Cl2 + 2NaBr → 2NaCl + Br2
Câu 8. Nhận biết các khí sau bằng phương pháp hóa học: Cl2, O2, HCl và SO2
Lời giải:
Đáp án:
Cho quỳ tím ẩm vào bốn mẫu khí, khí nào không có hiện tượng là O2, khí làm quỳ tím bạc màu là Cl2; hai khí làm quỳ tím ẩm hóa đỏ là HCl và SO2
- Dẫn hai khí còn lại qua dung dịch Br2 có màu vàng nâu nhạt, dung dịch brom bị mất màu là khí SO2, còn lại là HCl
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Câu 9. Tinh chế NaCl có lẫn NaBr, NaI, Na2CO3.
Lời giải:
Đáp án:
Hòa tan hỗn hợp vào nước tạo thành dung dịch hỗn hợp NaCl, NaBr, NaI, Na2CO3.
Thổi khí HCl vào chỉ có Na2CO3 phản ứng:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Thổi tiếp Cl2 (có dư) vào:
2NaBr + Cl2 → 2NaCl + Br2
2NaI + Cl2 → 2NaCl + I2
Cô cạn dung dịch H2O, Br2, I2 bay hơi hết còn lại NaCl nguyên chất.
Câu 10. Muối ăn bị lẫn tạp chất là Na2SO4, MgCl2, CaCl2 và CaSO4. Hãy trình bày phương pháp hóa học để loại bỏ các tạp chất, thu được NaCl tinh khiết. Viết phương trình hóa học của các phản ứng.
Lời giải:
Đáp án:
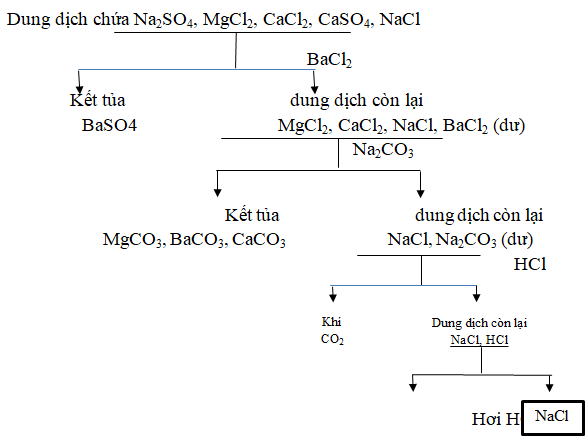
Các phương trình hóa học:
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
CaSO4 + BaCl2 → BaSO4↓ + CaCl2
MgCl2 + Na2CO3 → MgCO3↓ + 2NaCl
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.