Toptailieu.vn biên soạn và giới thiệu Phương pháp giải Công thức tính nhanh khối lượng muối clorua tạo thành sau phản ứng (50 bài tập minh họa) hay, chi tiết nhất, từ cơ bản đến nâng cao giúp học sinh nắm vững kiến thức, từ đó học tốt môn Hóa học 10.
Phương pháp giải Công thức tính nhanh khối lượng muối clorua tạo thành sau phản ứng (50 bài tập minh họa)
1. Các công thức tính nhanh:
- Công thức tính khối lượng muối clorua khi cho kim loại tác dụng với dung dịch HCl giải phóng khí H2
mmuối clorua = mKL + 71. nH2
- Công thức tính khối lượng muối clorua thu được khi hòa tan hết hỗn hợp kim loại bằng dung dịch HCl vừa đủ
mmuối clorua = mKL + 35,5.nHCl
- Công thức tính khối lượng muối clorua thu được khi hòa tan hết hỗn hợp oxit kim loại bằng dung dịch HCl
mmuối clorua = moxit + 27,5.nHCl
- Công thức tính khối lượng muối clorua khi cho muối cacbonat tác dụng với dung dịch HCl giải phóng khí CO2 và H2O
mmuối clorua = mmuối cacbonat + 11 nCO2
- Công thức tính khối lượng muối clorua khi cho muối sunfit tác dụng với dung dịch HCl giải phóng khí SO2 và H2O
mmuối clorua = mmuối sunfit – 9. nSO2
Ví dụ: Hòa tan hết 10 gam hỗn hợp kim loại gồm Mg, Zn, Al vào dung dịch HCl thu được dung dịch Y và 7,84 lít H2 (đktc). Cô cạn dung dịch Y thu được m gam muối khan. Giá trị của m là
A. 11,7 gam B. 26 gam C. 34,85 gam D. 35 gam
Hướng dẫn giải:
nH2 = 0,35 mol
Hỗn hợp kim loại + HCl → muối clorua + H2
mmuối clorua = mKL + 71.
→ m = 10 + 71.0,35 = 34,85 gam
→ Chọn C
2. Bạn nên biết
Các phương trình phản ứng xảy ra
- Kim loại tác dụng với dung dịch HCl giải phóng khí H2
2M + 2nHCl → 2MCln + nH2
- Oxit kim loại tác dụng với dung dịch HCl
M2On + 2nHCl → 2MCln + nH2O
- Muối cacbonat kim loại tác dụng với dung dịch HCl
M2(CO3)n + 2nHCl → 2MCln + nH2O + nCO2
- Muối sunfit kim loại tác dụng với dung dịch HCl
M2(SO3)n + 2nHCl → 2MCln + nH2O + nSO2
3. Mở rộng
Công thức bảo toàn nguyên tố
Giả sử ta có hợp chất AxBy
nA = x.n AxBy → n AxBy= 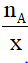
nB = y.n AxBy → n AxBy= 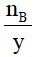
VD: Với phản ứng kim loại tác dụng với dung dịch HCl giải phóng khí H2
2M + 2nHCl → 2MCln + nH2
mmuối clorua= mMCLn = 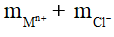
Bảo toàn nguyên tố H và Cl ta có: nCl- = nH+ = 1. nHCL = 2n H2
→ mcl- = 35,5.2. nH2 = 71.
Vậy ta có: mmuối clorua = mKL + 71. nH2

4. Bài tập minh họa
Câu 1: Hòa tan hoàn toàn 15 gam hỗn hợp Fe2O3 và MgO vào 150ml dung dịch HCl 2M (vừa đủ), sau đó cô cạn dung dịch, thu được m gam muối khan. Giá trị của m là
A. 23,25 gam B. 25,23 gam C. 46,5 gam D. 50,46 gam
Hướng dẫn giải
nHCl = 0,3 mol
oxit kim loại + HCl → muối clorua + H2O
→ mmuối clorua = moxit + 27,5.nHCl
→ m = 15 + 27,5.0,3 = 23,25 gam
→ Chọn A
Câu 2: Cho 44,5 gam hỗn hợp bột Zn, Mg tác dụng với dung dịch HCl dư thấy có 22,4 lít khí H2 bay ra (đktc). Khối lượng muối clorua tạo ra trong dung dịch là :
A. 80. B. 115,5. C. 51,6. D. 117,5.
Hướng dẫn giải:
= 1 mol
Kim loại + HCl → muối clorua + H2
→ mmuối clorua = mKL + 71.
→ mmuối clorua = 44,5 + 71.1 = 115,5 gam
Câu 3: Hoà tan hoàn toàn 10,05 gam hỗn hợp 2 muối cacbonat kim loại hoá trị II và III vào dung dịch HCl thu được dung dịch A và 0,672 lít khí (đktc). Khối lượng muối trong A là :
A. 10,38 gam. B. 20,66 gam. C. 30,99 gam. D. 9,32 gam.
Hướng dẫn giải:
nCO2 = 0,03 mol
Muối cacbonat + HCl → muối chorua + CO2 + H2O
mmuối clorua = mmuối cacbonat + 11 nCO2
→ m muối clorua = 10,05 + 11.0,03 = 10,38 gam
→ Chọn A
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.