Toptailieu.vn biên soạn và giới thiệu Phương pháp giải 50 bài tập về hợp chất của lưu huỳnh (50 bài tập minh họa) hay, chi tiết nhất, từ cơ bản đến nâng cao giúp học sinh nắm vững kiến thức, từ đó học tốt môn Hóa học 10.
Phương pháp giải 50 bài tập về hợp chất của lưu huỳnh (50 bài tập minh họa)
1. Bài tập về SO2, H2S, SO3 hoặc H2SO4 phản ứng với dung dịch kiềm
Bài toán 1: SO2 + NaOH hoặc KOH
SO2 + NaOH → NaHSO3 (1)
SO2 + 2NaOH → Na2 SO3 + H2 O (2)
Lập tỉ lệ T =
T≤ 1 → chỉ xảy ra phản ứng (1) tức tạo muối NaHSO3 (muối axit)
1<T<2 → xảy ra cả (1) và (2) tức tạo 2 muối NaHSO3 và Na2 SO3
T≥ 2 → chỉ xảy ra phản ứng (2) tức tạo muối Na2 SO3 (muối trung hòa)
Bài toán 2: SO2 + Ba(OH) 2 /Ca(OH) 2
SO2 + Ba(OH) 2 → BaSO3 ↓+ H2 O (1)
2SO2 + Ba(OH) 2 → Ba(HSO3) 2 (2)
Lập tỉ lệ T =
T≤ 1 → chỉ xảy ra phản ứng (1) tức tạo muối BaSO3 ↓
1<T<2 → xảy ra cả (1) và (2) tức tạo 2 muối BaSO3↓ và Ba(HSO3)2
T≥ 2 → chỉ xảy ra phản ứng (2) tức tạo muối Ba(HSO3) 2 (muối tan, không tạo kết tủa)
Ví dụ 1 : Hấp thụ 3,36 lít khí SO2 (đktc) vào 200 ml dung dịch NaOH aM. Tính a biết sau phản ứng chỉ thu được muối trung hòa.
Lời giải:
Vì đề cho chỉ tạo muối trung hòa nên chỉ xảy ra phản ứng
SO2 + 2NaOH → Na2 SO3 + H2 O
0,15 → 0,3
NSO2 = 0,15 mol , VNaOH = 200 ml = 0,2 lít
→ a = CM (NaOH)= 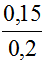
Ví dụ 2: Hấp thụ hoàn toàn 12,8g SO2 vào 250 ml dung dịch NaOH 1M. Tính khối lượng muối tạo thành sau phản ứng.
Lời giải:
nSO2 = 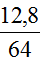
nNaOH = 0,25.1 = 0,25 mol
1 < T = 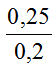
→ Tạo 2 muối NaHSO3 và Na2 SO3
PTHH:
SO2 + NaOH → NaHSO3
x mol → x mol x
SO2 + 2NaOH → Na2 SO3 + H2 O
y mol → 2y mol y
→ mNaHSO3sub> = 0,15. 104 = 15,6g
mNa2O3 = 0,05 . 126 = 6,3g
Nhận xét : Có thể nhẩm nhanh trắc nghiệm: số mol 2 muối = số mol SO2
n Na2O3 = nNaOH - nSO2 = 0,25 – 0,2 = 0,05 mol
n NaHSO3 = nSO2 - n Na2O3 = 0,2 – 0,05 = 0,15 mol
Ví dụ 3: Hấp thụ 6,72 lít khí SO2 (đktc) vào 100 ml dung dịch Ba(OH) 2 2M. Tính khối lượng muối thu được
Lời giải:
NSO2 = 0,3 mol; nBa(OH)2 = 0,2 mol
1 < T = 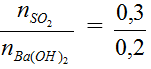
→ tạo 2 muối
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
a mol → a mol a
Ba(OH) 2 + 2SO2 → Ba(HSO3)2
b mol → 2b b
→ mBaSO3 = 0,1 . 217 = 12,7g
mBa(HSO3)2 = 0,1.299 = 29,9g
Cách 2:
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
x mol → x mol → x mol
BaSO3 + SO2dư + H2O → Ba(HSO3) 2
x mol → x mol
tạo kết tủa, khi dư SO2, kết tủa bị hòa tan, để hòa tan hết kết tủa nSO2 ít nhất = 2x= 2nBa(OH)2
Nếu lượng SO2 không đủ để hòa tan hết kết tủa, thì kết tủa chỉ bị tan một phần tức tồn tại 2 muối BaSO3 và Ba(HSO3) 2
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
0,2 → 0,2 0,2
BaSO3 + SO2dư + H2O → Ba(HSO3) 2
0,1 ← (0,3-0,2) → 0,1
NBaSO3còn lại = 0,2 – 0,1 = 0,1 mol
Cách 3: Nhẩm trắc nghiệm: để hòa tan hết kết tủa nSO2 = 2nBa(OH)2 , nếu lượng kết tủa chỉ bị tan một phần
NSO2 = 2nBa(OH)2 - nkết tủa (vì tỉ lệ số mol hòa tan kết tủa là 1:1)
→ nBaSO3còn lại = 2nBa(OH)2 - nSO2 = 2.0,2 – 0,3 = 0,1 mol
Số mol 2 muối = số mol Ba(OH) 2 → nBa(HSO3)2 = nBa(OH)2 - nBaSO3còn lại = 0,2 – 0,1 = 0,1 mol
→ mBaSO3 = 0,1 . 217 = 12,7g
MBa(HSO3)2 = 0,1.299 = 29,9g
Ví dụ 4: Hấp thụ V lít SO2 (đktc) vào 300 ml dung dịch Ba(OH)2 1M thu được 21,7g kết tủa. Tính V
Lời giải:
Trường hợp 1: Ba(OH) 2dư, SO2 hết , nSO2 = n BaSO3
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
0,1 ←0,1
→ VSO2 = 0,1. 22,4 = 2,24 lít
Trường hợp 2: Ba(OH) 2hết, SO2dư nhưng không hòa tan hết kết tủa ( kế t tủa chỉ tan một phần)
a(OH) 2 + SO2 → BaSO3↓+ H2O
0,1 0,1 ←0,1
Ba(OH) 2 + 2SO2 → Ba(HSO3) 2
( 0,3 – 0,1) → 0,4
→ nSO2 = 0,1 + 0,4 = 0,5 mol
→ VSO2 = 0,5. 22,4 = 11,2lít
(tính nhanh nSO2 = 2nBa(OH)2 - n↓ = 2. 0,3 – 0,1 = 0,5 mol)
Ví dụ 5: Dẫn khí SO2 qua 200 ml dung dịch Ba(OH) 2 aM thu được 21,7 g kết tủa, thêm tiếp dung dịch NaOH đến dư vào lại thu thêm 10,85 gam kết tủa nữa. Tính a
Lời giải:
Thêm NaOH lại thu thêm kết tủa, chứng tỏ trong dung dịch tồn tại muối Ba(HSO3) 2, mà vẫn có kết tủa
→ tồn tại 2 muối
n↓(1) = = 0,1 mol
n↓(2) = = 0,05 mol
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
0,1 0,1
Ba(OH) 2 + 2SO2 → Ba(HSO3) 2
0,05 ←0,05
Ba(HSO3) 2 + 2NaOH → BaSO3 ↓ + Na2SO3 + 2H2O
0,05 ←0,05
nBa(OH)2 = 0,1 + 0,05 = 0,15 mol → a = = 0,75M
Cách 2: 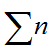
Ba(OH) 2 → BaSO3
0,15 ←0,15
→ a =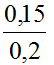
Ví dụ 6. Trộn 200 ml dung dịch NaOH 1M với 150ml dung dich H2SO4 1M. Hỏi sau khi phản ứng kết thúc khôi lượng muối thu được là bao nhiêu?
Lời giải:
Ta có: nNaOH =0,2 × 1=0,2(mol); nH2SO4= 0,15 mol
Phản ứng: NaOH + H2SO4 → NaHSO4 + H2O
(mol) 0,15← 0,15 → 0,15
NaOH + NaHSO4 → Na2SO4 + H2O
(mol) 0,05 → 0,05
⇒ nNaHSO4dư = 0,15 – 0,05 =0,1 (mol)
⇒ mmuối = mNaHSO4 + mNa2SO4=120 ×0,1 + 142×0,05=19,1(gam)
Ví dụ 7. Cho 80 gam SO3 vào một cốc nước sau đó thêm nước vào đến vạch 0,5 lít thì dừng (gọi là dung dịch A).
a) Tính nồng độ mol/l của dung dịch A.
b) Cho 20 ml dung dịch A vào dung dịch BaCl2 dư. Hãy tính khối lượng kết tủa thu được.
c) Để trung hòa 20ml dung dịch KOH thì cần 10ml dung dịch A. Tính nồng độ mol/l của dung dịch KOH.
Lời giải:
Ta có: nSO3 = 80/80 = 1
SO3 + H2O → H2SO4 (1)
(mol) 1 → 1
Từ (1) ⇒
Phản ứng:
H2SO4 + BaCl2 → BaSO4 ↓+ 2HCl (2)
(mol) 0,04 → 0,04
Ta có:
Từ (2) ⇒nBaSO4= 0,04(mol) ⇒ mBaSO4=0,04 × 233=9,32 (gam)
Ta có:
2KOH + H2SO4 → K2SO4 + 2H2O (3)
(mol) 0,04 ← 0,02
Từ (3) ⇒ nKOH = 0,04 (mol) ⇒
2. Bài tập về S, H2S và muối sunfua
Chú ý:
- S phản ứng với kim loại tạo muối sunfua của kim loại với hóa trị thấp.
- Tính tan của muối sunfua trong nước và trong axit.
Ví dụ 1. Có hai muối là natri hiđrosunfit và sắt sunfua. Cho hai muôi này tác dụng với axit HCl dư, thu được hai chất khí. Cho hai chất khí vừa thu được tác dụng với nhau, tạo thành 9,6 gam chất rắn. Tính khối lượng của NaHSO3 và FeS đã lấy để phản ứng. Biết hai khí tác dụng với nhau vừa đủ
Lời giải:
Phản ứng:
NaHSO3 + HCl → NaCl + SO2 ↑ + H2O (1)
(mol) 0,1 ← 0,1
FeS + 2HCl → FeCl2 + H2S ↑ (2)
(mol) 0,2 ← 0,2
SO2+ 2H2S → 3S↓ + 2H2O (3)
(mol) 0,1 0,2 ← 0,3
Ta có:
Từ (1) ⇒ nNaHSO3=0,1(mol)⇒ mNaHSO3=0,1×104=10,4(gam)
Từ (2) ⇒ nFeS=0,2(mol) ⇒ mFeS = 0,2 ×88 = 17,6 (gam)
Ví dụ 2. Đun nóng một hỗn hợp bột gồm 2,97 gam Al và 4,08 gam S trong môi trường kín không có không khí, được sản phẩm là hỗn hợp rắn A. Ngâm A trong dung dịch HCl dư, thu được hỗn hợp khí B.
a) Hãy viết phương trình hóa học của các phản ứng.
b) Xác định thành phần định tính và khối lượng các chất trong hỗn hợp A.
c) Xác định thành phần định tính và thể tích các chất trong hỗn hợp khí B ở điều kiện tiêu chuẩn.
Lời giải:
Phản ứng:
2Al + 3S → Al2S3 (1)
2Al + 6HCl → 2AlCl3 + 3H2 (2)
Al2S3 _+ 6HCl → 2AlCl3 + 3H2S (3)
Số mol Al=0,11 (mol); Số mol S=0,1275 (mol)
⇒ nAl dư =0,015 mol
Hỗn hợp A gồm Al dư và Al2S3
Vậy: mAl=0,025 × 27=0,675(gam)
Hỗn hợp khí B gồm H2 và H2S
VH2= 1,5×0,025×22,4=0,84(lít)
VH2S=0,1275 ×22,4=2,856 (lít)
Ví dụ 3. Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb(NO3) 2 (dư), thu được 23,9 gam kết tủa đen.
a) Viết các phương trình hóa học của phản ứng đã xảy ra.
b) Hỗn hợp khí thu được gồm những khí nào? Thể tích mỗi khí là bao nhiêu (đktc)?
c) Tính khối lượng của Fe và FeS có trong hỗn hợp ban đầu.
Lời giải:
Các phản ứng xảy ra:
Fe + 2HCl → FeCl2 + H2 ↑ (1)
(mol) x → x
FeS + 2HCl → FeCl2 + H2 S ↑ (2)
(mol) y → y
H2 S + Pb(NO3 ) 2 → PbS↓+ 2HNO3 (3)
(mol) 0,1 ←0,1
Gọi x và y lần lượt là số mol của Fe và FeS
Ta có: nFeS =0,1(mol) và nkhí =0,11 (mol)
Hỗn hợp khí thu được gồm H2 và H2 S
Từ (3) ⇒ nH2 = y = nPbS = 0,1 mol (*)
Từ (1), (2) ta có: x + y=0,11 (**)
Từ (*) và (**)⇒ x=0,01; y=0,1
Vậy: VH2 =0,01 ×22,4=1,224(lít) ; VH2S =22,4 ×0,1=2,24(lít)
c) Từ (1) ⇒ nFe =nH2=0,01 (mol) ⇒ mFe = 0,01 ×56=0,56 (gam)
Từ (2) ⇒ nFeS = nH2S=0,1(mol) ⇒s mFeS = 0,1 ×88=8,8(gam)
Ví dụ 4. Đun nóng hỗn hợp 5,6 gam bột sắt và 1,6 gam bột lưu huỳnh thu được hỗn hợp X. Cho hỗn hợp X phản ứng hoàn toàn với 500ml dung dịch HC1 thu được hỗn hợp khí A và dung dịch B. Biết H = 100%).
Tính thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp (X).
Biết rằng cần phải dùng 125 ml dung dịch NaOH 0,1M để trung hòa HCl dư trong dung dịch B. Hãy tính nồng độ mol/l của dung dịch HCl đã dùng.
Lời giải:
Tính phần trăm thể tích mỗi khí trong A
Ta có: nFe =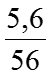
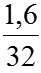
Phản ứng: Fe + S 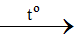
(mol) 0,05 ←0,05 → 0,05
Từ (1) ⇒ nFe : nS =1 : 1 và nFe = 0,1 ; nS=0,05 ⇒ Sau phản ứng (1) thì Fe còn dư
Fedư + 2HCl → FeCl2 + H2 ↑ (2)
(mol) 0,05 → 0,1 0,05
FeS + 2HCl → FeCl2 + H2 S ↑ (3)
(mol) 0,05 → 0,1 0,05
Từ (2), (3) ⇒ nH2= nH2S=0,05(mol)⇒%V H2S=50%
Ta có: nNaOH = 0,125 × 0,1=0,0125 (mol)
Phản ứng: HCl dư + NaOH → NaCl + H2 O (4)
(mol) 0,0125 ←0,0125
Từ (2), (3), (4) ⇒ ∑nHCl =0,1 +0,1 + 0,0125= 0,2125 (mol)
Vậy :
Ví dụ 5: Cho m gam hỗn hợp X gồm Fe và FeS tác dụng với dung dịch HCl dư thu được 2,464 lít hỗn hợp khí Y (đktc). Cho hỗn hợp khí Y đi qua dung dịch Pb(NO3 ) 2 (dư) thu được 23,9g kết tủa màu đen.
a, Viết các phương trình phản ứng xảy ra
b, Tính thể tích mỗi khí trong Y và m
Trả lời:
nY = 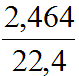
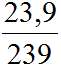
Fe + HCl → FeCl2 + H2
0,01 ← (0,11-0,1)
FeS + 2HCl → FeCl2 + H2S
0,1 ←0,1
H2S + Pb(NO3) 2 → PbS↓ + 2HNO3
0,1 ← 0,1
→ VH2S = 0,1 . 22,4 = 2,24 lít
VH2 = 0,01 . 22,4 = 0,224 lít
m = mFe + mFeS = 0,01. 56 + 0,1 . 88 = 9,36g
3)Bài tập về Axit Sunfuric H2SO4
*Cần nhớ:
Axit H2SO4 có tính axit mạnh (tương tự như HCl)
+) Tác dụng với kim loại tạo thành muối sunfat và H2
2M + nH2SO4 → M2(SO4)n + nH2 ↑
(M đứng trước H2, n là số oxi hóa thấp nhất của kim loại)
+) Tác dụng với oxit bazơ , bazơ tạo thành muối và H2O
FeO + H2SO4 → FeSO4 + H2 O
Fe3O4+ 4H2SO4 → FeSO4 + Fe2 (SO4)3 + 4H2O
Fe(OH)2 + 2H2SO4 → FeSO4 + 2H2O
+) Tác dụng với muối tọa thành muối mới và axit mới
BaCl2 + H2SO4 → BaSO4 ↓+ 2HCl
FeS + H2SO4 → FeSO4 + H2S↑
Axit H2SO4 đặc có tính oxi hóa mạnh
Với kim loại:
M: Fe → ZN M2
(SO4)m + SO2 ↑+ H2O
(m là hóa trị cao nhất của M; Al, Fe, Cr bị thụ động hóa trong H2SO4 đặc, nguội)
Với phi kim
S + 2H2SO4 đặc → 3SO2↑ + 2H2O
2P + 2H2SO4 đặc → H3PO4 + SO2↑ + H2O
C + H2SO4 đặc → CO2↑ + SO2↑ + H2O
Với hợp chất có tính khử
+) Các hợp chất Fe2+ → Fe3+
+) Các hợp chất S-1, S-2 → S+4
Phản ứng:
2Fe3O4 + 10H2SO4 → 3Fe2 (SO4)3 + SO2 ↑+ 10H2O
2Fe(OH) 2 + 4H2SO4 → Fe2 (SO4)3 + SO2 ↑+ 6H2O
2FeS2+ 14H2SO4 → 3Fe2 (SO4)3+ 15SO2 ↑+ 14H2O
3Cách tính nhanh số mol anion SO42- tạo muối và số mol H2SO4 tham gia phản ứng trong phản ứng oxi – hóa khử
Không phụ thuộc vào bản chất và số lượng các kim loại, ta luôn có các bán phản ứng khử: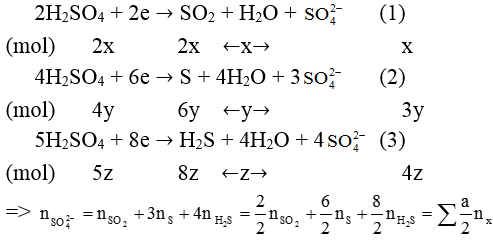
Chú ý: nSO-24 tạo muối =
nH2SO4phản ứng phản ứng = 2nSO2 + 4ns + 5nH2
(Hai biểu thức trên chỉ áp dụng nếu hỗn hợp ban đầu là các kim loại)
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.