Toptailieu.vn biên soạn và giới thiệu Phương pháp giải Công thức tính nhanh khối lượng muối sunfat (50 bài tập minh họa) hay, chi tiết nhất, từ cơ bản đến nâng cao giúp học sinh nắm vững kiến thức, từ đó học tốt môn Hóa học 10.
Phương pháp giải Công thức tính nhanh khối lượng muối sunfat (50 bài tập minh họa)
1. Công thức tính nhanh khối lượng muối sunfat
Dạng 1: Kim loại + H2SO4 loãng → muối sunfat + H2↑
mmuối sufat = mkim loại + 96.nH2
Dạng 2: Kim loại + H2SO4 đặc , nóng → muối sunfat +(SO2 , H2S, S)+ H2O
mmuối= mKL phản ứng + nSO42-trong muối
nSO42-trong muối = ![]() (6ns + 2nSO2 + 8nH2S ) . 96
(6ns + 2nSO2 + 8nH2S ) . 96
mmuối= mKL phản ứng + 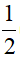 (6ns + 2nSO2 + 8nH2S ) . 96
(6ns + 2nSO2 + 8nH2S ) . 96
Lưu ý:
+ Sản phẩm khử nào không có trong phản ứng thì số mol bằng 0.
2. Bạn nên biết
- Các kim loại Al, Fe, Cr thụ động trong H2SO4 đặc , nguội.
- Đối với axit H2SO4 đặc thì sản phẩm khử thường là SO2 ( đối với các kim loại như Fe, Cu, Ag); là SO2 hoặc S hoặc H2S (đối với các kim loại có tính khử mạnh như Mg, Al, Zn, Cr)
3. Mở rộng
- Hiện tượng thụ động là axit đã oxi hóa bề mặt các kim loại tạo thành một màng oxit có tính trơ, làm cho các kim loại này thụ động. Kim loại bị thụ động sẽ không sẽ không tác dụng với các dung dịch HCl, H2SO4 loãng.
4. Bài tập minh họa
Câu 1: Hoà tan hết 1,72 gam hỗn hợp kim loại gồm Mg, Al, Zn, Fe bằng dung dịch H2SO4 loãng thu được V lít khí ở đktc và 7,48 gam muối sunfat khan. Giá trị của V là:
A. 1,344 lít
B. 1,008 lít
C. 1,12 lít
D. 3,36 lít
Hướng dẫn
Gọi nH2= x.mol -> nH2SO4 = nH2= xmol
Bảo toàn khối lượng ta có:
mm= mKL + m SO42-
-> 7,48= 1,72 + 96x
-> x= 0,06 mol
-> VH2 = 0,06.22,4= 1,344 lít
Đáp án A
Câu 2: Hoà tan hết hỗn hợp X gồm Fe và 0,24 mol kim loại M trong dung dịch H2SO4 loãng dư thu được dung dịch A và 10,752 lít khí H2 ở đktc. Cô cạn dung dịch A thu được 59,28 gam muối khan. Kim loại M là :
A. Mg
B. Ca
C. Al
D. Na
Hướng dẫn
Gọi nFe = x mol
Kim loại M nhường n electron và có nguyên tử khối là M.
nH2SO4 = nH2 = 0,48 mol
-> nSO42-= 0,48 mol
Ta có: mmuối khan = mkim loại + mSO42-
59,28 = 56x + 0,24. M + 0,48.96
56x + 0,24. M = 13,2 gam (1)
Bảo toàn electron ta có:
2x + 0,24.n=0,48.2
56x = 26,88 - 6,72n
Thay vào (1) ta được: 26,88 – 6,72 n+ 0,24.M=13,2
M= 28n - 57
-> 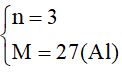
Đáp án C
Câu 3: Cho m gam Fe tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng (dư) thu được 6,72 lít khí SO2 (ở đktc). Tính khối lượng muối thu được?
A. 46 gam
B. 44 gam
C. 42 gam
D. 40 gam
Hướng dẫn
Phương trình : 2Fe + 6H2SO4 Fe2(SO4)3 + 3SO2 + 6H2O
nSO2= 0,3 mol ; nFe = 0,2 mol
Cách 1:
nFe2(SO4)3 = 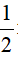 nFe = 0,1 mol
nFe = 0,1 mol
-> mFe2(SO4)3= 0,1.400= 40 gam
Cách 2:
mmuối = mkim loại + mSO42- =0,2.56+ 0,3.96=40 gam
Đáp án D
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.