Toptailieu.vn biên soạn và giới thiệu Phương pháp giải Trắc nghiệm lý thuyết Tốc độ phản ứng và cân bằng hóa học (50 bài tập minh họa) hay, chi tiết nhất, từ cơ bản đến nâng cao giúp học sinh nắm vững kiến thức, từ đó học tốt môn Hóa học 10.
Phương pháp giải Trắc nghiệm lý thuyết Tốc độ phản ứng và cân bằng hóa học (50 bài tập minh họa)
Câu 1: Để đánh giá mức độ xảy ra nhanh hay chậm của các phản ứng hoá học người ta dùng đại lượng nào dưới đây?
A. Nhiệt độ. B. Tốc độ phản ứng.
C. Áp suất. D. Thể tích khí.
Câu 2: Tốc độ phản ứng là?
A. Độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
B. Độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
C. Độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
D. Độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
Câu 3: Phương án nào dưới đây mô tả đầy đủ nhất các yếu tố ảnh hưởng đến tốc độ phản ứng?
A. Nồng độ, nhiệt độ, chất xúc tác, áp suất.
B. Nồng độ, nhiệt độ, chất xúc tác.
C. Nồng độ, nhiệt độ, chất xúc tác, áp suất, tốc độ khuấy trộn, diện tích bề mặt chất rắn.
D. Nồng độ, nhiệt độ, chất xúc tác, áp suất, tốc độ khuấy trộn, khối lượng chất rắn.
Câu 4: Định nghĩa nào sau đây là đúng ?
A. Chất xúc tác là chất làm giảm tốc độ phản ứng, nhưng không bị tiêu hao trong phản ứng.
B. Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng bị tiêu hao trong phản ứng.
C. Chất xúc tác là chất làm tăng tốc độ phản ứng, còn lại sau khi phản ứng kết thúc.
D. Chất xúc tác là chất làm thay đổi tốc độ phản ứng, nhưng bị tiêu hao không nhiều trong phản ứng.
Câu 5: Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng nhôm ở dạng nào sau đây?
A. Dạng viên nhỏ. B. Dạng bột mịn, khuấy đều.
C. Dạng tấm mỏng. D. Dạng nhôm dây.
Câu 6: Tốc độ phản ứng tăng lên khi:
A. Giảm nhiệt độ
B. Tăng diện tích tiếp xúc giữa các chất phản ứng
C. Tăng lượng chất xúc tác
D. Giảm nồng độ các chất tham gia phản ứng
Câu 7: Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây:
A. Thời gian xảy ra phản ứng B. Bề mặt tiếp xúc giữa các chất phản ứng
C. Nồng độ các chất tham gia phản ứng. D. Chất xúc tác
Câu 8: Khi cho cùng một lượng magie vào cốc đựng dung dịch axit HCl, tốc độ phản ứng sẽ lớn nhất khi dùng magie ở dạng:
A. Viên nhỏ B. Bột mịn, khuấy đều
C. Lá mỏng D. Thỏi lớn
Câu 9: Cho các yếu tố sau:
a. Nồng độ chất. b. Áp suất c. Xúc tác d. Nhiệt độ e. Diện tích tiếp xúc.
Những yếu tố ảnh hưởng đến tốc độ phản ứng nói chung là:
A. a, b, c, d. B. b, c, d, e. C. a, c, e. D. a, b, c, d, e.
Câu 10: Khi ninh (hầm) thịt cá, người ta sử dụng những cách sau.
(1) Dùng nồi áp suất (2) Chặt nhỏ thịt cá.
(3) Cho thêm muối vào. (4) Nấu cùng nước lạnh.
Cách làm cho thịt cá nhanh chín hơn là:
A. 1, 2, 3. B. 1,3,4. C. 2,3,4. D. 1,2,4.
Câu 11: Phát biểu nào sau đây đúng?
A. Nói chung, các phản ứng hoá học khác nhau xảy ra nhanh chậm với tốc độ khác nhau không đáng kể.
B. Tốc độ phản ứng là độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
C. Tốc độ phản ứng chỉ có trong phản ứng một chiều.
D. Tốc độ phản ứng chỉ được xác định theo lý thuyết.
Câu 12: Hoàn thành phát biểu về tốc độ phản ứng sau:
"Tốc độ phản ứng được xác định bởi độ biến thiên ...(1)... của ...(2)... trong một đơn vị ...(3)..."
A. (1) nồng độ, (2) một chất phản ứng hoặc sản phẩm, (3) thể tích.
B. (1) nồng độ, (2) một chất phản ứng hoặc sản phẩm, (3) thời gian.
C. (1) thời gian, (2) một chất sản phẩm, (3) nồng độ.
D. (1) thời gian, (2) các chất phản ứng, (3) thể tích.
Câu 13: Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do?
A. Nồng độ của các chất khí tăng lên.
B. Nồng độ của các chất khí giảm xuống.
C. Chuyển động của các chất khí tăng lên.
D. Nồng độ của các chất khí không thay đổi.
Câu 14: Các yếu tố ảnh hưởng tới tốc độ của một phản ứng gồm
A. nhiệt độ, áp suất, nồng độ, chất xúc tác.
B. nhiệt độ, nồng độ, chất xúc tác.
C. nhiệt độ, áp suất, diện tích tiếp xúc, nồng độ.
D. nhiệt độ, áp suất, nồng độ, diện tích tiếp xúc, chất xúc tác.
Câu 15: Chất xúc tác trong phản ứng hóa học có tác dụng làm tăng tốc độ phản ứng, sau khi phản ứng xong chất xúc tác sẽ
A. phản ứng vừa đủ.
B. phản ứng xong vẫn còn dư một ít.
C. không thay đổi.
D. phản ứng thiếu so với các chất tham gia phản ứng.
Câu 16: Điền vào chỗ trống bằng cụm từ thích hợp: “Tốc độ phản ứng là đại lượng đặc trưng cho biến thiên … của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
A. nồng độ. B. nhiệt độ. C. thành phần. D. tính chất.
Câu 17: Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
A. Tốc độ phản ứng. B. Cân bằng hóa học.
C. Phản ứng một chiều. D. Phản ứng thuận nghịch.
Câu 18: Chất xúc tác trong phản ứng thuận nghịch làm
A. tăng tốc độ phản ứng thuận.
B. tăng tốc độ phản ứng nghịch.
C. tăng hiệu suất phản ứng thuận.
D. phản ứng mau đạt trạng thái cân bằng.
Câu 19: Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng lên là do
A. nồng độ của các chất khí tăng lên.
B. nồng độ của các chất khí giảm xuống.
C. chuyển động của các chất khí tăng lên.
D. nồng độ của các chất khí không thay đổi.
Câu 20: Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu
A. Nhiệt độ. B. Chất xúc tác. C. Nồng độ D. Áp suất.
Câu 21: Cho phản ứng hoá học: A + B → C + D
Yếu tố nào không ảnh hưởng đến tốc độ phản ứng?
A. Nhiệt độ B. Nồng độ C và D
C. Chất xúc tác D. Nồng độ A và B
Câu 22: Chọn câu đúng trong các câu dưới đây.
A. Bếp than đang cháy trong nhà cho ra ngoài trời sẽ cháy chậm hơn.
B. Sục CO2 vào dung dịch Na2CO3 trong điều kiện áp suất thấp khiến phản ứng nhanh hơn.
C. Nghiền nhỏ vừa phải CaCO3 giúp phản ứng nung vôi diễn ra dễ dàng hơn.
D. Thêm MnO2 vào quá trình nhiệt phân KClO3 sẽ làm giảm lượng O2 thu được.
Câu 23: Người ta thường sử dụng nhiệt của phản ứng đốt cháy than đá để nung vôi. Biện pháp kĩ thuật nào dưới đây không được sử dụng để làm tăng tốc độ phản ứng nung vôi?
A. Đập nhỏ đá vôi với kích thước khoảng 10 cm.
B. Tăng nhiệt độ phản ứng lên khoảng 900oC.
C. Tăng nồng độ khí cacbonic.
D. Thổi không khí nén vào lò nung vôi.
Câu 24: Phản ứng thuận nghịch là phản ứng
A. trong cùng điều kiện, phản ứng xảy ra theo hai chiều trái ngược nhau.
B. có phương trình hoá học được biểu diễn bằng mũi tên một chiều.
C. chỉ xảy ra theo một chiều nhất định.
D. xảy ra giữa hai chất khí.
Câu 25: Trong quá trình sản xuất gang, xảy ra phản ứng:
Fe2O3 (r) + 3CO(k) 2Fe(r) + 3CO2(k) ΔH >0
Có thể dùng những biện pháp nào dưới đây để tăng tốc độ phản ứng?
A. Tăng nhiệt độ phản ứng.
B. Tăng kích thước quặng Fe2O3.
C. Nén khí CO2 vào lò.
D. Tăng áp suất chung của hệ.
Câu 26: Cho một cục đá vôi nặng 1 gam vào dung dịch HCl 2M, ở nhiệt độ 25oC. Biến đổi nào sau đây không làm bọt khí thoát ra mạnh hơn?
A. Tăng thể tích dung dịch HCl lên gấp đôi.
B. Thay cục đá vôi bằng 1 gam bột đá vôi
C. Thay dung dịch HCl 2M bằng dung dịch HCl 4M
D. Tăng nhiệt độ lên 50oC
Câu 27: Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào đã được sử dụng để làm tăng tốc độ phản ứng?
A. Nhiệt độ, áp suất. B. Diện tích tiếp xúc.
C. Nồng độ. D. Xúc tác.
Câu 28: Thực hiện 2 thí nghiệm theo hình vẽ sau.
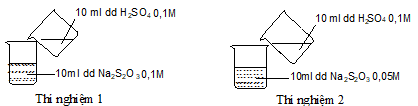
Ở thí nghiệm nào có kết tủa xuất hiện trước?
A. Thí nghiệm 1 có kết tủa xuất hiện trước.
B. Thí nghiệm 2 có kết tủa xuất hiện trước.
C. Kết tủa xuất hiện đồng thời.
D. Không có kết tủa xuất hiện.
Câu 29: Khi đốt cháy axetilen, nhiệt lượng giải phóng ra lớn nhất khi axetilen
A. cháy trong không khí.
B. cháy trong khí oxi nguyên chất.
C. cháy trong hỗn hợp khí oxi và khí nitơ.
D. cháy trong hỗn hợp khí oxi và khí cacbonic.
Câu 30: Khi đốt củi, để tăng tốc độ cháy, người ta sử dụng biện pháp nào sau đây?
A. Thổi hơi nước. B. Xếp củi chặt khít.
C. Đốt trong lò kín. D. Thổi không khí khô.
Câu 31: Phát biểu nào dưới đây không đúng?
A. Khi đốt củi, nếu thêm một ít dầu hỏa lửa sẽ cháy to hơn. Như vậy, dầu hỏa đóng vai trò xúc tác cho quá trình này.
B. Để thực phẩm tươi lâu, người ta dung phương pháp bảo quản lạnh. Ở nhiệt độ thấp, quá trình phân hủy các chất diễn ra chậm hơn.
C. Khi làm sữa chua, lúc đầu người ta phải pha sữa trong nước ấm và thêm men.
D. Nhiệt độ của ngọn lửa axetilen cháy trong không khí thấp hơn nhiều so với cháy trong oxi.
Câu 32: Cho cùng một lượng kẽm vào các cốc khác nhau chứa cùng một lượng dung dịch axit sunfuric loãng, cốc nào sẽ có tốc độ phản ứng nhanh nhất?
A. Kẽm ở dạng viên tròn nhỏ. B. Kẽm ở dạng lá mỏng.
C. Kẽm ở dạng bột mịn. D. Kẽm ở dạng sợi, mảnh.
Câu 33: Cho 5,6 gam lá sắt kim loại vào 50 ml dung dịch axit HCl 3M ở nhiệt độ 30oC. Trường hợp nào sau đây sẽ không làm tăng tốc độ phản ứng
A. thay 5,6 gam lá sắt bằng 2,8 gam lá sắt.
B. tăng nhiệt độ phản ứng lên 50oC.
C. thay 5,6 gam lá sắt bằng 5,6 gam bột sắt.
D. thay axit HCl 3M thành axit HCl 4M.
Câu 34: Cho phản ứng: 2KClO3(r) 2KCl(r) + 3O2 (k). Yếu tố không ảnh hưởng đến tốc độ của phản ứng trên là?
A. Kích thước các tinh thể KClO3. B. Áp suất.
C. Chất xúc tác. D. Nhiệt độ.
Câu 35: Ở 25oC, kẽm ở dạng bột khi tác dụng với dung dịch HCl 1M, tốc độ phản ứng xảy ra nhanh hơn so với kẽm ở dạng hạt. Yếu tố ảnh hưởng đến tốc độ phản ứng trên là
A. nhiệt độ B. diện tích bề mặt tiếp xúc
C. nồng độ D. áp suất
Câu 36: Cho ba mẫu đá vôi (100% CaCO3) có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
A. t3 < t2 < t1 B. t2 < t1 < t3 C. t1 < t2 < t3 D. t1 = t2 = t3
Câu 37: Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào ảnh hưởng đến tốc độ phản ứng?
A. Nhiệt độ, áp suất B. Tăng diện tích
C. Chất xúc tác D. Nồng độ
Câu 38: Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối kali clorat. Người ta sử dụng cách nào sau đây nhằm mục đích tăng tốc độ phản ứng?
A. Nung kaliclorat ở nhiệt độ cao.
B. Nung hỗn hợp kali clorat và mangan đioxit ở nhiệt độ cao.
C. Dùng phương pháp dời nước để thu khí oxi.
D. Dùng phương pháp dời không khí để thu khí oxi.
Câu 39: Khi cho axit clohiđric tác dụng với kali pemanganat (rắn) để điều chế clo, khí clo sẽ thoát ra nhanh hơn khi dùng
A. axit clohiđric đặc và đun nhẹ hỗn hợp.
B. axit clohiđric đặc và làm lạnh hỗn hợp.
C. axit clohiđric loãng và đun nhẹ hỗn hợp.
D. axit clohiđric loãng và làm lạnh hỗn hợp.
Câu 40: Cân bằng hóa học liên quan đến loại phản ứng
A. không thuận nghịch. B. thuận nghịch.
C. một chiều. D. oxi hóa – khử.
Câu 41: Khi phản ứng thuận nghịch ở trạng thái cân bằng thì nó
A. không xảy ra nữa. B. vẫn tiếp tục xảy ra.
C. chỉ xảy ra theo chiều thuận. D. chỉ xảy ra theo chiều nghịch.
Câu 42: Đối với một hệ ở trạng thái cân bằng, nếu thêm vào chất xúc tác thì:
A. Chỉ làm tăng tốc độ phản ứng thuận
B. Chỉ làm tăng tốc độ phản ứng nghịch
C. Làm tăng tốc độ phản ứng thuận và nghịch với số lần như nhau.
D. Không làm tăng tốc độ của phan ứng thuận và nghịch
Câu 43: Phản ứng thuận nghịch là phản ứng
A. trong cùng điều kiện, phản ứng xảy ra theo hai chiều trái ngược nhau.
B. có phương trình hoá học được biểu diễn bằng mũi tên một chiều.
C. chỉ xảy ra theo một chiều nhất định.
D. xảy ra giữa hai chất khí.
Câu 44: Tại nhiệt độ không đổi, ở trạng thái cân bằng,
A. thành phần của các chất trong hỗn hợp phản ứng không thay đổi.
B. thành phần của các chất trong hỗn hợp phản ứng vẫn liên tục thay đổi.
C. phản ứng hoá học không xảy ra.
D. tốc độ phản ứng hoá học xảy ra chậm dần.
Câu 45: Sự dịch chuyển cân bằng hoá học là sự di chuyển từ trạng thái cân bằng hoá học này sang trạng thái cân bằng hoá học khác do
A. không cần có tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
B. tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
C. tác động của các yếu tố từ bên trong tác động lên cân bằng.
D. cân bằng hóa học tác động lên các yếu tố bên ngoài.
Câu 46: Các yếu tố ảnh hưởng đến cân bằng hoá học là :
A. nồng độ, nhiệt độ và chất xúc tác.
B. nồng độ, áp suất và diện tích bề mặt.
C. nồng độ, nhiệt độ và áp suất.
D. áp suất, nhiệt độ và chất xúc tác.
Câu 47: Sự dịch chuyển cân bằng hoá học là sự di chuyển từ trạng thái cân bằng hoá học này sang trạng thái cân bằng hoá học khác do
A. không cần có tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
B. tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
C. tác động của các yếu tố từ bên trong tác động lên cân bằng.
D. cân bằng hóa học tác động lên các yếu tố bên ngoài.
Câu 48: Phát biểu nào dưới đây không đúng?
A. Phản ứng thuận nghịch xảy ra đồng thời hai chiều trong cùng điều kiện.
B. Phản ứng một chiều có thể xảy ra hoàn toàn.
C. Phản ứng thuận nghịch không thể xảy ra hoàn toàn.
D. Hiệu suất phản ứng thuận nghịch có thể đạt đến 100%.
Câu 49: Cho cân bằng: N2 + 3H2 2NH3; ΔH < 0. Yếu tố không làm thay đổi trạng thái cân bằng là
A. Nồng độ của N2 và H2 B. Áp suất chung của hệ.
C. Chất xúc tác D. Nhiệt độ của hệ.
Câu 50: Sự tăng áp suất có ảnh hưởng như thế nào đến trạng thái cân bằng hóa học của phản ứng: H2(k) + Br2(k) 2HBr(k)
A. Cân bằng chuyển dịch sang chiều thuận.
B. Cân bằng dịch chuyển theo chiều nghịch.
C. Cân bằng không thay đổi.
D. Phản ứng trở thành một chiều.
Câu 51: Cho phương trình hoá học: N2(k) + O2(k) 2NO(k); ΔH > 0. Hãy cho biết cặp yếu tố nào sau đây đều ảnh hưởng đến sự chuyển dịch cân bằng hoá học trên?
A. Nhiệt độ và nồng độ B. Áp suất và nồng độ
C. Nồng độ và chất xúc tác D. Chất xúc tác và nhiệt độ
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.