Toptailieu.vn biên soạn và giới thiệu các kiến thức trọng tâm về Photpho (P) bao gồm định nghĩa, tính chất vật lí, tính chất hóa học, ứng dụng và cách điều chế của Photpho, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Photpho (P): Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
- Photpho là một phi kim
- Kí hiệu: P
- Cấu hình electron: 1s22s22p63s23p3 hay [Ne]3s23p3
- Số hiệu nguyên tử: Z = 15
- Khối lượng nguyên tử: 31
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 15, nhóm VA
+ Chu kì: 3
- Độ âm điện: 2,19
- Photpho có 2 dạng thù hình là photpho trắng và photpho đỏ
| Photpho trắng (P4) | Photpho đỏ (P4)n | |
| Tính chất vật lí |
- Là chất rắn màu trắng, mềm, nhiệt độ nóng chảy thấp (44,1oC), dễ bay hơi → kém bền. - Có cấu trúc mạng tinh thể phân tử |
- Là bột màu đỏ thẫm, bền hơn photpho trắng (có nhiệt độ sôi, nhiệt độ nóng chảy cao hơn) - Có cấu trúc polime |
| Độ tan |
- Không tan trong nước - tan được trong một số dung môi hữu cơ: CS2, benzen,… - Rất độc, gây bỏng nặng |
- Không tan trong các dung môi thông thường - Không độc, không gây bỏng da |
Nhận xét:
- Để đơn giản trong phản ứng hóa học người ta sử dụng kí hiệu P
- P vừa có tính khử vừa có tính oxi hóa
1. Tính khử
a. Khử phi kim mạnh hơn:O2, Cl2, S...
- Khử O2 :
Photpho trắng tác dụng với oxi ở điều kiện thường, phản ứng tỏa năng lượng ở dạng ánh sáng → gây ra hiện tượng phát quang hóa học
Photpho đỏ chỉ tác dụng với oxi ở nhiệt độ cao
- Khử : 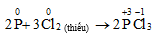
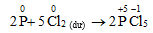
b. Khử một số hợp chất có tính oxi hóa mạnh
2. Tính oxi hóa
* P oxi hóa các kim loại hoạt động tạo ra photphua kim loại
- Trong tự nhiên, nguyên tố P chỉ có ở dạng hợp chất
+ Ở cơ thể sống: người, động vật, thực vật,…
+ Ở vỏ trái đất: quặng apatit (3Ca3(PO4)2.CaF2 ); quặng photphorit ( Ca3(PO4)2)
Quặng than cốc cát
- Điều chế H3PO4
- Sản xuất diêm
- Điều chế bom cháy, lựu đạn khói
- Axit photphoric ( H3PO4 )
- Muối của H3PO4
- Phân lân
VIII. Bài tập liên quan về Photpho (P)
Bài 1: Cho 44 gam NaOH 10% tác dụng với 10 gam axit H3PO4 39,2%.
a. Muối thu được là muối gì?
b. Tính nồng độ phần trăm muối trong dung dịch sau phản ứng.
Lời giải:
Số mol NaOH là nNaOH = 44.10/100.40 = 0,11 mol
Số mol H3PO4 là nH3PO4 = 10.39,2/100.98 = 0,04 mol
T = 0,11/0,04 = 2,75 mol ⇒ tạo ra 2 muối Na2HPO4 và Na3PO4
Phương trình phản ứng:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Ta có : x + y = 0,04 (1) và 2x + 3y = 0,11 (2) ⇒ x = 0,01 và y = 0,03 mol
⇒nNa2HPO4 = 0,01 mol và nNa3PO4 = 0,03 mol
mNa2HPO4 = 0,01.142 = 1,42 gam; mNa3PO4 = 0,03.164 = 4,92 gam
mdd = 44 + 10 = 54 gam
Nồng độ phần trăm của các muối trong dung dịch sau phản ứng là:
C%( Na2HPO4) = 1,42/54.100% = 2,63%; C%( Na3PO4) =4,92/54.100% = 9,11%
Bài 2: Cho 100 ml dung dịch H3PO4 0,2 M vào 1 lit dung dịch Ca(OH)2 0,012 M. Tính khối lượng muối tạo thành sau khi phản ứng xảy ra hoàn toàn.
Lời giải:
nH3PO4 = 0,02 mol; nOH- = 0,024 mol
T = 0,024/0,02 = 1,2 ⇒ tạo ra 2 muối H2PO4- và HPO42-
Phương trình phản ứng:
Ca(OH)2 + 2H3PO4 → Ca(H2PO4)2 + 2H2O
Ca(OH)2 + H3PO4 → CaHPO4 + 2H2O
Gọi số mol của Ca(H2PO4)2 và CaHPO4 lần lượt là x, y mol
Ta có : 2x + y = 0,02 (1) và x + y = 0,012 (2)
⇒x = 0,008 mol và y = 0,004 mol
Khối lượng các muối sau phản ứng là:
mCa(H2PO4)2 = 0,008. 234 = 1,872 gam
mCaHPO4 = 0,004. 136 = 0,544 gam
Bài 3: Cho 44g NaOH vào dd chứa 39,2g H3PO4. Sau khi phản ứng xảy ra hoàn toàn, đem cô cạn dd thu được đến cạn khô. Muối được tạo nên và khối lượng muối khan thu được là:
Lời giải:
T = 2,75 tạo 2 muối: Na2HPO4 (x mol) và Na3PO4 (y mol); 2x + 3y = 1,1 (1) và x + y = 0,4 (2) ⇒ x = 0,1 và y = 0,3.
Bài 4: Số mol P2O5 cần thêm vào dd chứa 0,03 mol KOH để thu được dd chứa 2 muối K2HPO4 và KH2PO4 với số mol bằng nhau:
Lời giải:
nK2HPO4 = nKH2PO4 = x mol; 2x + x = 0,03 ⇒ x= 0,01 mol; nH3PO4 = 0,01 + 0,01 = 0,02 mol ⇒ nP2O5 = 0,02/2 = 0,01 mol.
Bài 5: Cho 100 ml dung dịch H3PO4 tác dụng với 200 ml dung dịch NaOH a M thu được 1,2 gam muối NaH2PO4 và 1,42 mol Na2HPO4. Giá trị của a là:
Lời giải:
nNa2HPO4 = 0,01 mol; nNaH2PO4 = 0,01 mol; nNaOH = 0,01 + 0,01.2 = 0,03 mol ⇒ a = 0,03/0,2 = 0,15 M
Xem thêm các chất hữu cơ chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.