Với Giải SBT Hóa học 10 trang 9 trong Bài 2: Thành phần của nguyên tử Sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 trang 9.
SBT Hóa học 10 trang 9
Bài 2.13 trang 9 sách bài tập Hóa học 10: Tia âm cực phát ra trong ống âm cực bị lệch hướng khi đặt trong trường từ. Một dây dẫn mang điện cũng có thể bị hút bởi trường từ. Tia âm cực bị lệch hướng khi đặt gần một vật mang điện âm. Tính chất nào của tia âm cực được thể hiện qua các hiện tượng này?
Lời giải:
Thông qua các hiện tượng rút ra tính chất: Tia âm cực là dòng electron mang điện tích âm.
Bài 2.14 trang 9 sách bài tập Hóa học 10: Electron sinh ra trong ống tia âm cực chứa khí neon có khác electron sinh ra trong ống tia âm cực chứa khí chlorine không? Vì sao?
Lời giải:
Electron sinh ra trong ống tia âm cực chứa khí neon giống electron sinh ra trong ống tia âm cực chứa khí chlorine. Vì các electron không khác nhau về bản chất trong các môi trường khác nhau.
Bài 2.15 trang 9 sách bài tập Hóa học 10: Nguyên tử mang điện tích dương, điện tích âm hay trung hòa? Giải thích vì sao một nguyên tử có thể tồn tại ở trạng thái này.
Lời giải:
Nguyên tử trung hòa về điện vì trong nguyên tử, số proton bằng số electron (hay số đơn vị điện tích dương bằng số đơn vị điện tích âm).
Bài 2.16 trang 9 sách bài tập Hóa học 10: X là nguyên tố hóa học có trong thành phần của chất có tác dụng oxi hóa và sát khuẩn cực mạnh, thường được sử dụng với mục đích khử trùng và tẩy trắng trong lĩnh vực thủy sản, diệt nhuộm, xử lí nước cấp, nước thải, nước bể bơi. Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Xác định thành phần cấu tạo của nguyên tử X.
Lời giải:
Gọi p, n và e lần lượt là số proton, neutron và electron của X. Trong đó p = e.
Theo bài ra, ta có hệ phương trình:
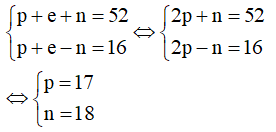
Vậy trong X có 17 proton; 17 electron và 18 neutron.
Bài 2.17 trang 9 sách bài tập Hóa học 10: Các hợp chất của nguyên tố Y được sử dụng như là vật liệu chịu lửa trong các lò sản xuất sắt, thép, kim loại màu, thủy tinh và xi măng. Oxide của Y và các hợp chất khác cũng được sử dụng trong nông nghiệp, công nghiệp hóa chất và xây dựng. Nguyên tử Y có tổng số các hạt là 36. Số hạt không mang điện bằng một nửa hiệu số giữa tổng số hạt với số hạt mang điện tích âm. Xác định thành phần cấu tạo của nguyên tử Y.
Lời giải:
Gọi p, n và e lần lượt là số proton, neutron và electron của Y. Trong đó p = e.
Theo bài ra ta có hệ phương trình:
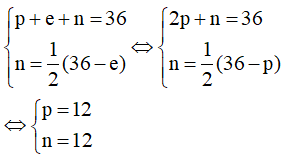
Vậy trong Y có 12 proton; 12 electron và 12 neutron.
Bài 2.18 trang 9 sách bài tập Hóa học 10: Nitrogen giúp bảo quản tinh trùng, phôi, máu và tế bào gốc. Biết nguyên tử nitrogen có tổng số hạt là 21. Số hạt không mang điện chiếm 33,33%. Xác định số đơn vị điện tích hạt nhân của nitrogen.
Lời giải:
Gọi p, n và e lần lượt là số proton, neutron và electron của nitrogen. Trong đó p = e.
Số hạt không mang điện chiếm 33,33% ⇒ số neutron = n =
Lại có: p + e + n = 21 ⇒ 2p + n = 21 (2)
Thế n = 7 vào (2) được p = 7.
Vậy nguyên tử nitrogen có số đơn vị điện tích hạt nhân là 7.
Bài 2.19 trang 9 sách bài tập Hóa học 10: Magnesium oxide (MgO) được sử dụng để làm dịu cơn đau ợ nóng và chua của chứng đau dạ dày. Tổng số hạt mang điện trong hợp chất MgO là 40. Số hạt mang điện trong nguyên tử Mg nhiều hơn số hạt mang điện trong nguyên tử O là 8. Xác định điện tích hạt nhân của Mg và O.
Lời giải:
Tổng số hạt mang điện trong hợp chất MgO là 40 nên:
(pMg + eMg) + (pO + eO) = 40 hay 2pMg + 2pO = 40 (1)
Lại có, số hạt mang điện trong nguyên tử Mg nhiều hơn số hạt mang điện trong nguyên tử O là 8 nên:
(pMg + eMg) - (pO + eO) = 8 hay 2pMg - 2pO = 8 (2)
Từ (1) và (2) giải hệ phương trình ta được: pMg = 12 và pO = 8.
Vậy điện tích hạt nhân Mg là +12; điện tích hạt nhân O là +8
Xem thêm lời giải vở bài tập Hóa học lớp 10 Chân trời sáng tạo với cuộc sống hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.