Với Giải SBT Hóa học 10 trang 29 trong Bài 8: Quy tắc octet Sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 trang 29.
SBT Hóa học 10 trang 29
Bài 8.5 trang 29 sách bài tập Hóa học 10: Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
A. Neon và argon
B. Helium và xenon
C. Helium và radon
D. Helium và krypton
Lời giải:
Đáp án đúng là: D
H (Z = 1): 1s1 khi hình thành liên kết trong phân tử HBr, H đã đạt cấu hình electron bền của khí hiếm helium với 2 electron lớp ngoài cùng.
Br (Z = 35): [Ar]3d104s24p5 khi hình thành liên kết trong phân tử HBr, Br đã đạt cấu hình electron bền của khí hiếm krypton.
Bài 8.6 trang 29 sách bài tập Hóa học 10: Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách.
A. cho đi 2 electron
B. nhận vào 1 electron
C. cho đi 3 electron
D. nhận vào 2 electron
Lời giải:
Đáp án đúng là: A
Mg (Z = 12): [Ne]3s2
Khi hình thành liên kết hóa học Mg có xu hướng nhường (cho) đi 2 electron để đạt được cấu hình electron bền vững giống khí hiếm.
Bài 8.7 trang 29 sách bài tập Hóa học 10: Cho các phân tử sau: Cl2, H2O, NaF và CH4. Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình electron bền của khí hiếm neon?
A. 3
B. 2
C. 5
D. 4
Lời giải:
Đáp án đúng là: D
Có 4 nguyên tử trong các phân tử đã cho đạt cấu hình electron bền vững của khí hiếm neon là O, Na, F và C.
Bài 8.8 trang 29 sách bài tập Hóa học 10: Nguyên tử trong phân tử nào dưới đây ngoại lệ với quy tắc octet?
A. H2O
B. NH3
C. HCl
D. BF3
Lời giải:
Đáp án đúng là: D
Trong phân tử BF3, nguyên tử B mới chỉ có 6 electron ở lớp ngoài cùng, chưa đạt được cấu hình electron bền vững của khí hiếm gần nhất.
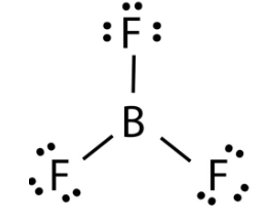
Bài 8.9 trang 29 sách bài tập Hóa học 10: Em hãy nêu tên và công thức hóa học của 1 chất ở thể rắn, 1 chất ở thể lỏng và 1 chất ở thể khí (trong điều kiện thường), trong đó nguyên tử oxygen đạt được cấu hình bền của khí hiếm neon.
Lời giải:
Nguyên tử oxygen đạt được cấu hình electron bền của khí hiếm Ne trong MgO (chất rắn); H2O (chất lỏng) và O2 (chất khí).
Bài 8.10 trang 29 sách bài tập Hóa học 10: Potassium iodide (KI) được sử dụng như một loại thuốc long đờm, giúp làm lỏng và phá vỡ chất nhầy trong đường thở, thường dùng cho các bệnh nhân hen suyễn, viêm phế quản mãn tính. Trong trường hợp bị nhiễm phóng xạ, KI còn giúp ngăn tuyến giáp hấp thụ iodine phóng xạ, bảo vệ và giảm nguy cơ ung thư tuyến giáp. Trong phân tử KI, các nguyên tử K và I đều đã đạt được cơ cấu bền của khí hiếm gần nhất. Đó lần lượt là những khí hiếm nào?
Lời giải:
K (Z = 19): [Ar]4s1 → có xu hướng nhường 1 electron khi hình thành liên kết hóa học.
I (Z = 53): [Kr]4d105s25p5 → có xu hướng nhận 1 electron khi hình thành liên kết hóa học.
Trong phân tử potassium iodide (KI), nguyên tử K và I lần lượt đạt cơ cấu bền của khí hiếm gần nhất là Ar (argon) và Xe (xenon).
Xem thêm lời giải vở bài tập Hóa học lớp 10 Chân trời sáng tạo với cuộc sống hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.