Toptailieu biên soạn và sưu tầm lời giải bài tập Hóa học lớp 10 Bài 8: Quy tắc octet sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 8 từ đó học tốt môn Hóa học 10.
Nội dung bài viết
Hoá học 10 Chân trời sáng tạo Bài 8: Quy tắc octet
Mở đầu trang 52 Hóa học 10: Khi liên kết với nhau, nguyên tử của các nguyên tố dường như đã cố gắng “bắt chước” cấu hình electron nguyên tử của các nguyên tố khí hiếm để bền vững hơn. Điều này đã được nhà hóa học người Mỹ Lewis (Li-uýt, 1875 – 1946) đề nghị khi nghiên cứu về sự hình thành phân tử từ các nguyên tử. Ông gọi đó là quy tắc octet. Quy tắc octet là gì?

Lời giải:
Quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
1. Liên kết hóa học
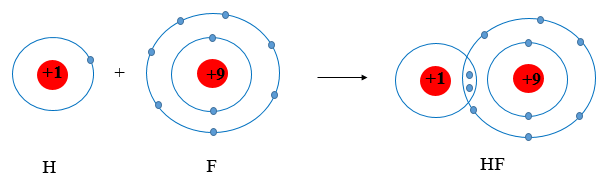
Câu hỏi 1 trang 52 Hóa học 10: Hình 8.1 giải thích sự hình thành phân tử hydrogen (H2) và fluorine (F2) từ các nguyên tử. Theo em, các nguyên tử hydrogen và fluorine đã “bắt chước” cấu hình electron của các nguyên tử khí hiếm nào khi tham gia liên kết?
Lời giải:
- Sự hình thành phân tử H2:
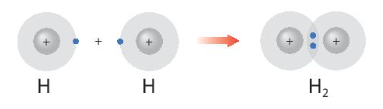
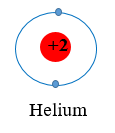
Sau khi tham gia liên kết nguyên tử H: Có 1 lớp electron, 2 electron ở lớp ngoài cùng ⇒ Giống cấu hình electron của He.
- Sự hình thành phân tử F2:
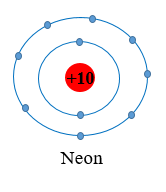
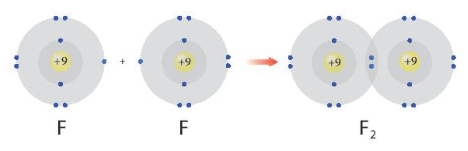 Sau khi hình thành liên kết Nguyên tử F: Có 2 lớp electron, 8 electron ở lớp ngoài cùng ⇒ Giống cấu hình electron của Ne
Sau khi hình thành liên kết Nguyên tử F: Có 2 lớp electron, 8 electron ở lớp ngoài cùng ⇒ Giống cấu hình electron của Ne
Lời giải:
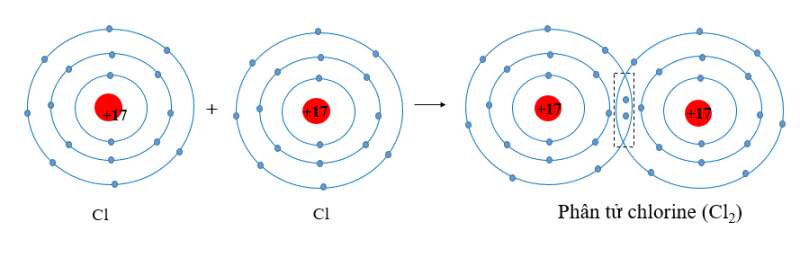
- Nguyên tử chlorine có 7 electron ở lớp ngoài cùng. Khi 2 nguyên tử Cl liên kết với nhau, mỗi nguyên tử Cl sẽ góp 1 electron để tạo 1 cặp electron dùng chung tạo thành cấu hình electron bền vững của khí hiếm
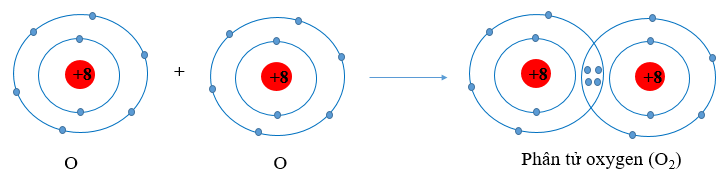
- Nguyên tử oxygen có 6 electron ở lớp ngoài cùng. Khi 2 nguyên tử O liên kết với nhau, mỗi nguyên tử O sẽ góp 2 electron để tạo 2 cặp electron dùng chung tạo thành cấu hình electron bền vững của khí hiếm
2. Quy tắc octet
Lời giải:
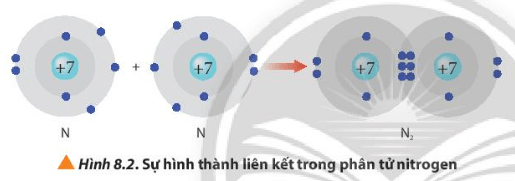
Sau khi tham gia liên kết, mỗi nguyên tử nitrogen 8 electron ở lớp ngoài cùng và có 2 lớp electron
⇒ Đạt được cấu hình electron bền vững của nguyên tử khí hiếm neon
Luyện tập trang 53 Hóa học 10: Nguyên tử của các nguyên tố hydrogen và fluorine có xu hướng cho đi, nhận thêm hay góp chung các electron hóa trị khi tham gia liên kết hình thành phân tử hydrogen fluoride (HF)?
Lời giải:
- Nguyên tử fluorine và hydrogen đều là phi kim
+ Fluorine thuộc nhóm VIIA ⇒ có 7 electron lớp ngoài cùng.
+ Hydrogen thuộc nhóm IA ⇒ có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron)
⇒ Cả 2 có xu hướng nhận electron để đạt cấu hình electron của khí hiếm
⇒ Khi tham gia liên kết hình thành phân tử HF, mỗi nguyên tử sẽ gọp chung 1 electron để tạo thành cặp electron dùng chung.
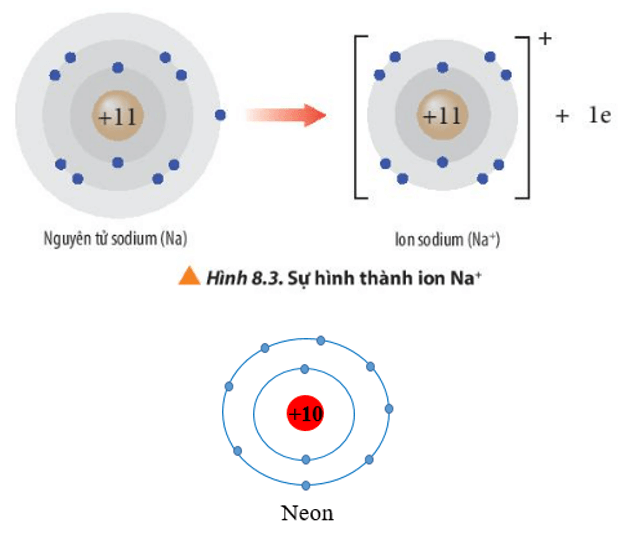
Lời giải:
- Ion sodium có 2 lớp electron và có 8 electron ở lớp ngoài cùng ⇒ Giống cấu hình electron của khí hiếm neon.
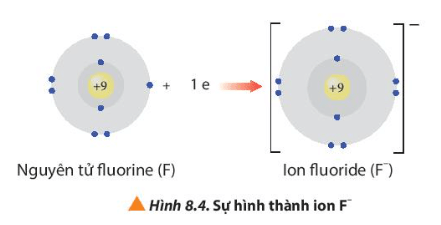
- Ion fluoride có 2 lớp electron và có 8 electron ở lớp ngoài cùng ⇒ Giống cấu hình electron của khí hiếm neon.
Lời giải:
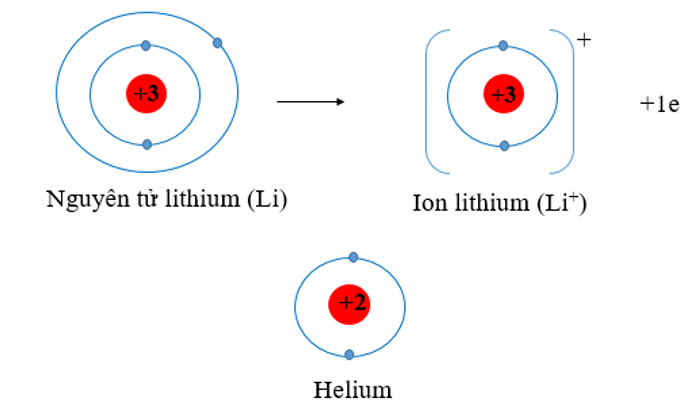
Lithium có số hiệu nguyên tử: Z = 3 ⇒ Cấu hình electron: 1s22s1
⇒ Lithium có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm He. Phần tử thu được mang điện tích dương, gọi là ion lithium, kí hiệu Li+
Lời giải:
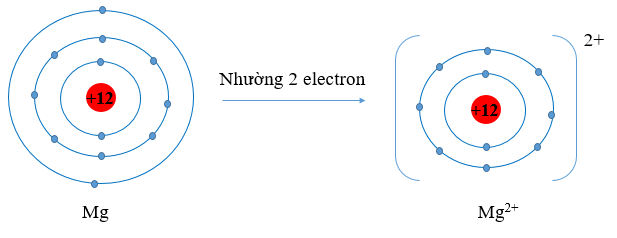
- Nguyên tử Mg có Z = 12 ⇒ Cấu hình electron: 1s22s22p63s2
⇒ Nguyên tử Mg có 2 electron lớp ngoài cùng. Nguyên tử Mg sẽ nhường 2 electron tạo thành ion Mg2+ để đạt cấu hình electron bền vững của khí hiếm:
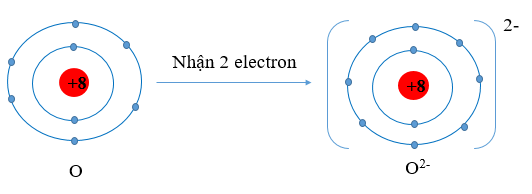
- Nguyên tử O có Z = 8 ⇒ Cấu hình electron: 1s22s22p4
⇒ Nguyên tử O có 6 electron lớp ngoài cùng ⇒ Nguyên tử O sẽ nhận 2 electron tạo thành ion O2- để đạt cấu hình electron bền vững của khí hiếm:
A. Fluorine
B. Oxygen
C. Hydrogen
D. Chlorine
Lời giải:
Đáp án đúng là: D
- Fluorine (Z = 9): 1s22s22p5⇒ Có 7 electron lớp ngoài cùng ⇒ Có xu hướng nhận 1 electron thành F- có cấu hình: 1s22s22p6 giống với cấu hình khí hiếm Ne.
- Oxygen (Z = 8): 1s22s22p4 ⇒ Có 6 electron lớp ngoài cùng ⇒ Có xu hướng nhận 2 electron thành O2- có cấu hình: 1s22s22p6 giống với cấu hình khí hiếm Ne.
- Hydrogen (Z = 1): 1s1⇒ Có xu hướng góp chung 1 electron để tạo thành 1 cặp electron dùng chung đạt cấu hình: 1s2 giống với cấu hình khí hiếm He.
- Chlorine (Z = 17): 1s22s22p63s23p5⇒ Có xu hướng nhận 1 electron thành Cl- có cấu hình: 1s22s22p63s23p6 giống với cấu hình khí hiếm Ar.
Vậy nguyên tử của nguyên tố chlorine có xu hướng đạt cấu hình electron bền vững của khí hiếm argon
A. 2 electron
B. 3 electron
C. 1 electron
D. 4 electron
Lời giải:
Đáp án đúng là: C
- Nguyên tử potassium có Z = 19
⇒ Cấu hình electron: 1s22s22p63s23p64s1
⇒ Có 1 electron lớp ngoài cùng ⇒ Có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm Ar: 1s22s22p63s23p6
Lời giải:
- Nguyên tử K (Z = 19): 1s22s22p63s23p64s1 ⇒ Có 1 electron lớp ngoài cùng ⇒ Có xu hướng nhường 1 electron này để đạt cấu hình electron giống khí hiếm.
Phần tử thu được mang điện tích dương, gọi là ion potassium, kí hiệu K+
- Nguyên tử Cl (Z = 17): 1s22s22p63s23p5 ⇒ Có 7 electron lớp ngoài cùng ⇒ Có xu hướng nhận 1 electron từ nguyên tử K để đạt cấu hình electron giống khí hiếm.
Phần tử thu được mang điện tích âm, gọi là ion chlorine, kí hiệu, Cl-
- Hai ion trái dấu hút nhau tạo thành phân tử potassium chloride (KCl)
- Sơ đồ mô tả:
Lời giải:
- Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron lớp ngoài cùng ⇒ Có xu hướng nhận 2 electron để đạt được cấu hình electron giống khí hiếm.
- Nguyên tử H (Z = 1): 1s1 ⇒ Có xu hướng nhận 1 electron để đạt được cấu hình electron giống khí hiếm.
⇒ Mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử O (góp chung 2 electron) tạo thành 2 cặp electron dùng chung
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.