Với giải Câu hỏi trang 54 SGK Hoá học10 Chân trời sáng tạo trong Bài 8: Quy tắc octet giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Chân trời sáng tạo trang 54 Bài 8: Quy tắc octet
Lời giải:
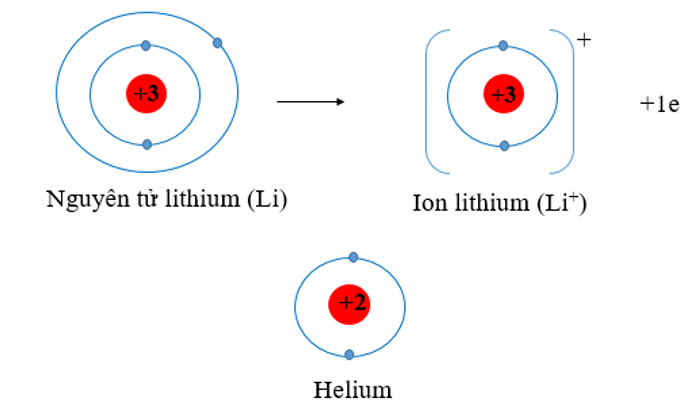
Lithium có số hiệu nguyên tử: Z = 3 ⇒ Cấu hình electron: 1s22s1
⇒ Lithium có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm He. Phần tử thu được mang điện tích dương, gọi là ion lithium, kí hiệu Li+
Lời giải:
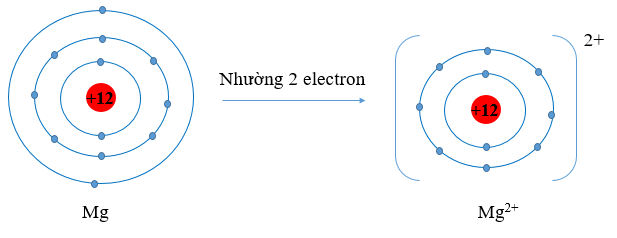
- Nguyên tử Mg có Z = 12 ⇒ Cấu hình electron: 1s22s22p63s2
⇒ Nguyên tử Mg có 2 electron lớp ngoài cùng. Nguyên tử Mg sẽ nhường 2 electron tạo thành ion Mg2+ để đạt cấu hình electron bền vững của khí hiếm:
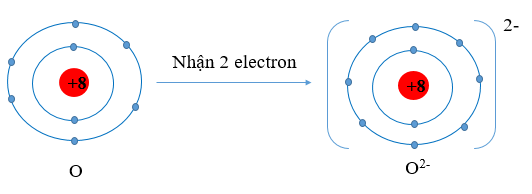
- Nguyên tử O có Z = 8 ⇒ Cấu hình electron: 1s22s22p4
⇒ Nguyên tử O có 6 electron lớp ngoài cùng ⇒ Nguyên tử O sẽ nhận 2 electron tạo thành ion O2- để đạt cấu hình electron bền vững của khí hiếm:
A. Fluorine
B. Oxygen
C. Hydrogen
D. Chlorine
Lời giải:
Đáp án đúng là: D
- Fluorine (Z = 9): 1s22s22p5⇒ Có 7 electron lớp ngoài cùng ⇒ Có xu hướng nhận 1 electron thành F- có cấu hình: 1s22s22p6 giống với cấu hình khí hiếm Ne.
- Oxygen (Z = 8): 1s22s22p4 ⇒ Có 6 electron lớp ngoài cùng ⇒ Có xu hướng nhận 2 electron thành O2- có cấu hình: 1s22s22p6 giống với cấu hình khí hiếm Ne.
- Hydrogen (Z = 1): 1s1⇒ Có xu hướng góp chung 1 electron để tạo thành 1 cặp electron dùng chung đạt cấu hình: 1s2 giống với cấu hình khí hiếm He.
- Chlorine (Z = 17): 1s22s22p63s23p5⇒ Có xu hướng nhận 1 electron thành Cl- có cấu hình: 1s22s22p63s23p6 giống với cấu hình khí hiếm Ar.
Vậy nguyên tử của nguyên tố chlorine có xu hướng đạt cấu hình electron bền vững của khí hiếm argon
A. 2 electron
B. 3 electron
C. 1 electron
D. 4 electron
Lời giải:
Đáp án đúng là: C
- Nguyên tử potassium có Z = 19
⇒ Cấu hình electron: 1s22s22p63s23p64s1
⇒ Có 1 electron lớp ngoài cùng ⇒ Có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm Ar: 1s22s22p63s23p6
Lời giải:
- Nguyên tử K (Z = 19): 1s22s22p63s23p64s1 ⇒ Có 1 electron lớp ngoài cùng ⇒ Có xu hướng nhường 1 electron này để đạt cấu hình electron giống khí hiếm.
Phần tử thu được mang điện tích dương, gọi là ion potassium, kí hiệu K+
- Nguyên tử Cl (Z = 17): 1s22s22p63s23p5 ⇒ Có 7 electron lớp ngoài cùng ⇒ Có xu hướng nhận 1 electron từ nguyên tử K để đạt cấu hình electron giống khí hiếm.
Phần tử thu được mang điện tích âm, gọi là ion chlorine, kí hiệu, Cl-
- Hai ion trái dấu hút nhau tạo thành phân tử potassium chloride (KCl)
- Sơ đồ mô tả:
Lời giải:
- Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron lớp ngoài cùng ⇒ Có xu hướng nhận 2 electron để đạt được cấu hình electron giống khí hiếm.
- Nguyên tử H (Z = 1): 1s1 ⇒ Có xu hướng nhận 1 electron để đạt được cấu hình electron giống khí hiếm.
⇒ Mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử O (góp chung 2 electron) tạo thành 2 cặp electron dùng chung
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 52 Hóa học 10: Khi liên kết với nhau, nguyên tử của các nguyên tố dường như đã cố gắng “bắt chước” cấu hình electron nguyên tử...
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.