Toptailieu biên soạn và sưu tầm lời giải bài tập Hóa học lớp 10 Bài 12: Phản ứng oxi hoá - khử và ứng dụng trong cuộc sống sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 12 từ đó học tốt môn Hóa học 10.
Hoá học 10 Chân trời sáng tạo Bài 12: Phản ứng oxi hoá - khử và ứng dụng trong cuộc sống
Mở đầu trang 72 Hóa học 10: Đom đóm có thể phát ra ánh sáng đặc biệt, không tỏa nhiệt như ánh sáng nhân tạo. Cấu tạo bên trong lớp da bụng của đom đóm là dãy các tế bào phát quang có chứa luciferin. Luciferin tác dụng với oxygen, cùng xúc tác enzyme, để tạo ra ánh sáng. Đây là phản ứng oxi hóa – khử.
Trong cuộc sống cũng như trong tự nhiên có nhiều hiện tượng mà nguyên nhân chính là do phản ứng oxi hóa – khử gây ra. Phản ứng oxi hóa – khử là gì? Vai trò quan trọng của chúng trong cuộc sống như thế nào?

Lời giải:
- Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử. Trong phản ứng oxi hóa – khử luôn xảy ra đồng thời quá trình oxi hóa và quá trình khử.
- Vai trò của phản ứng oxi hóa khử trong cuộc sống:
+ Một số phản ứng oxi hóa – khử quan trọng gắn liền với cuộc sống như sự cháy của than, củi; sự cháy của xăng, dầu trong các động cơ đốt trong; các quá trình điện phân; các phản ứng xảy ra trong pin, ắc quy; …
+ Một số phản ứng oxi hóa – khử là cơ sở của quá trình sản xuất trong các ngành công nghiệp năng; sản xuất các hóa chất cơ bản; sản xuất phân bón; thuốc bảo vệ thực vật; dược phẩm;…
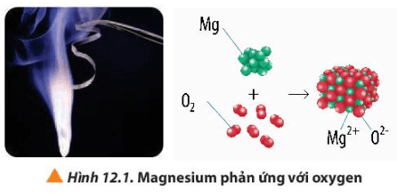
Lời giải:
Quá trình nhường electron: Mg → Mg2+ + 2e
Quá trình nhận electron: O2 + 4e → 2O2-
Câu hỏi 2 trang 73 Hóa học 10: Quan sát Hình 12.2a hydrogen cháy trong chlorine với ngọn lửa sáng, tạo hợp chất hydrogen chloride (HCl). Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl (Hình 12.2b), hãy xác định điện tích của các nguyên tử trong phân tử HCl
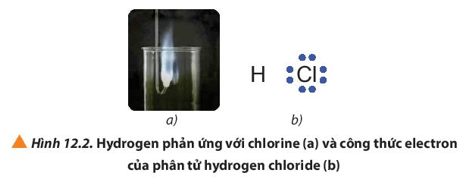
Lời giải:
Giả định nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl khi đó có thể coi Cl nhận 1 electron và H nhường 1 electron
⇒ Cl mang điện tích -1 và H mang điện tích +1
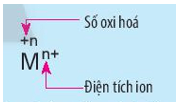
Lời giải:
Kí hiệu số oxi hóa: Dấu viết trước, số viết sau.
Kí hiệu điện tích ion: số viết trước, dấu viết sau.
Lời giải:
- Các nguyên tử nguyên tố nhóm IA đều có 1 electron lớp ngoài cùng, trong quá trình hình thành liên kết hóa học có xu hướng nhường đi 1 electron này để đạt được cấu hình electron bền vững của khí hiếm.
⇒ Các nguyên tử trong nhóm IA có số oxi hóa là +1
- Các nguyên tử nguyên tố nhóm IIA đều có 2 electron lớp ngoài cùng, trong quá trình hình thành liên kết hóa học có xu hướng nhường đi 2 electron này để đạt được cấu hình electron bền vững của khí hiếm.
⇒ Các nguyên tử trong nhóm IIA có số oxi hóa là +2
- Các nguyên tử nguyên tố nhóm IIIA đều có 3 electron lớp ngoài cùng, trong quá trình hình thành liên kết hóa học có xu hướng nhường đi 3 electron này để đạt được cấu hình electron bền vững của khí hiếm.
⇒ Các nguyên tử trong nhóm IIIA có số oxi hóa là +3.
Lời giải:
- Số oxi hóa của nguyên tử trong các đơn chất bằng 0
⇒ Số oxi hóa:
- Đối với ion đơn nguyên tử, số oxi hóa của nguyên tử trong ion bằng điện tích của ion đó.
⇒ Số oxi hóa của nguyên tử Cl, O, S trong Cl‑, O2-, S2-lần lượt bằng -1; -2; -2.
- Đối với ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích của ion đó.
- Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, số oxi hóa của oxygen bằng -2.
⇒ Xét ion HSO4-
+ Số oxi hóa của H là +1, của O là -2
+ Số oxi hóa của S là x ta có: 1.(+1) + 1.x + 4.(-2) = -1 ⇒ x = +6
- Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0.
- Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1.
⇒ Xét phân tử Na2S2O3
+ Số oxi hóa của Na là +1
+ Số oxi hóa của O là -2
+ Số oxi hóa của S là x ta có: 2.(+1) + 2.x + 3.(-2) = 0 ⇒ x = +2
Xét phân tử KNO3
+ Số oxi hóa của K là +1
+ Số oxi hóa của O là -2
+ Số oxi hóa của N là x ta có: 1.(+1) + 1.x + 3.(-2) = 0 ⇒ x = +5
Luyện tập trang 74 Hóa học 10: Magnetite là khoáng vật sắt từ có hàm lượng sắt cao nhất được dùng trong ngành luyện gang, thép, với công thức hóa học là Fe3O4. Hãy xác định số oxi hóa của nguyên tử Fe trong hợp chất trên.

Lời giải:
Đặt số oxi hóa của Fe là x ta có:
3.x + 4. (-2) = 0 ⇒ x =
Vậy số oxi hóa của Fe trong Fe3O4 là
Lời giải:
Chất oxi hóa là chất nhận electron ⇒ Số oxi hóa giảm sau phản ứng.
Chất khử là chất nhường electron ⇒ Số oxi hóa tăng sau phản ứng.
Luyện tập trang 75 Hóa học 10: Cho phương trình hóa học của các phản ứng sau:
H2S + Br2 → 2HBr + S↓ (1)
2KClO3 2KCl + 3O2↑ (2)
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O (3)
Phản ứng nào là phản ứng oxi hóa – khử? Vì sao? Hãy xác định quá trình oxi hóa và quá trình khử của các phản ứng đó
Lời giải:
Phản ứng (1) và (2) là phản ứng oxi hóa khử vì có sự thay đổi số oxi hóa của các nguyên tử trước và sau phản ứng.
Phản ứng (3) không phải là phản ứng oxi hóa khử vì không có sự thay đổi số oxi hóa của nguyên tử nào trước và sau phản ứng.
- Xét phương trình hóa học:
Quá trình oxi hóa:
Quá trình khử:
- Xét phương trình hóa học:
Quá trình oxi hóa:
Quá trình khử:
Câu hỏi 6 trang 76 Hóa học 10: Làm thế nào để biết một phản ứng là phản ứng oxi hóa – khử?
Lời giải:
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đối số oxi hóa của một số nguyên tử trước và sau phản ứng.
KMnO4 + HCl → KCl + MnCl2 + Cl↑ + H2O (1)
NH3 + Br2 → N2 + HBr (2)
NH3 + CuO Cu + N2 + H2O (3)
FeS2 + O2 Fe2O3 + SO2 (4)
KClO3 KCl + O2↑ (5)
Lời giải:
KMnO4 + HCl → KCl + MnCl2 + Cl↑ + H2O (1)
Bước 1:
Chất khử: HCl
Chất oxi hóa: KMnO4
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
NH3 + Br2 → N2 + HBr (2)
Bước 1:
Chất khử: NH3
Chất oxi hóa: Br2
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
2NH3 + 3Br2 → N2 + 6HBr
NH3 + CuO Cu + N2 + H2O (3)
Bước 1:
Chất khử: NH3
Chất oxi hóa: CuO
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
2NH3 + 3CuO 3Cu + N2 + 3H2O
FeS2 + O2 Fe2O3 + SO2 (4)
Bước 1:
Chất khử: FeS2
Chất oxi hóa: O2
Bước 2: Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
4FeS2 + 11O2 2Fe2O3 + 8SO2
KClO3 KCl + O2↑ (5)
Bước 1:
KClO3 vừa là chất khử, vừa là chất oxi hóa
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
2KClO3 2KCl + 3O2↑
Câu hỏi 7 trang 77 Hóa học 10: Lập phương trình hóa học của phản ứng đốt cháy gas trong không khí và phản ứng kích nổ hỗn hợp nhiên liệu của tàu con thoi. Xác định vai trò của các chất trong mỗi phản ứng
Lời giải:
- Gas (thành phần chính là hỗn hợp propane (C3H8) và butane (C4H10) được hóa lỏng).
Phản ứng đốt cháy gas trong không khí:
Trong hai phản ứng trên C3H8 và C4H10 đều là chất khử, O2 là chất oxi hóa.
- Phản ứng kích nổ hỗn hợp nhiên liệu của tàu con thoi:
H2 là chất khử, O2 là chất oxi hóa
Câu hỏi 8 trang 78 Hóa học 10: Quan sát Hình 12.7 và đọc thông tin, hãy lập phương trình hóa học của phản ứng quang hợp ở cây xanh. Quá trình quang hợp của thực vật có vai trò quan trọng như thế nào đối với cuộc sống?
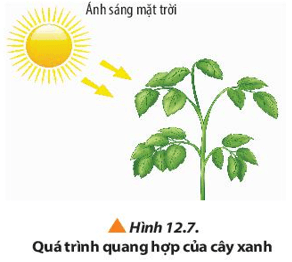
Lời giải:
- Phương trình hóa học của phản ứng quang hợp ở cây xanh:
6CO2 + 6H2O C6H12O6 + 6O2
- Vai trò của phản ứng quang hợp:
+ Điều hòa không khí trên Trái Đất (giảm lượng khí thải carbon dioxide gây hiệu ứng nhà kính, cung cấp oxygen cho hoạt động sống của con người, động vật và thực vật).
+ Tổng hợp chất hữu cơ carbohydrate là nguồn thức ăn cho mọi sinh vật, là nguyên liệu cho công nghiệp và làm ra thuốc chữa bệnh cho con người.
+ Cung cấp năng lượng cho hoạt động sống của sinh vật. Năng lượng trong ánh sáng mặt trời được hấp thụ và chuyển thành hóa năng trong các liên kết hóa học.
Câu hỏi 9 trang 78 Hóa học 10: Từ thông tin về “Luyện kim”, viết phản ứng của khí carbon monoxide khử iron(III) oxide ở nhiệt độ cao. Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron, xác định vai trò của các chất trong phản ứng
Lời giải:
Phản ứng của khí carbon monoxide khử iron(III) oxide ở nhiệt độ cao:
CO + Fe2O3 CO2 + Fe
- Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron:
Bước 1:
Chất khử: CO
Chất oxi hóa: Fe2O3
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4: Fe2O3 + 3CO 2Fe + 3CO2
Câu hỏi 10 trang 78 Hóa học 10: Đọc thông tin về “Điện hóa” để biết được phản ứng oxi hóa – khử gắn liền với cuộc sống. Lập phương trình hóa học của phản ứng sinh ra dòng điện trong pin khi zinc phản ứng với manganese.
Lời giải:
Zn + MnO2 ZnO + Mn2O3
Bước 1:
Chất khử: Zn
Chất oxi hóa: MnO2
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4: Zn + 2MnO2 ZnO + Mn2O3
Lời giải:
Một số phản ứng oxi hóa – khử quan trọng gắn với đời sống hằng ngày:
- Phản ứng đốt than để đun nấu:
C + O2 CO2
- Phản ứng đốt cháy nhiên liệu để chạy động cơ:
C2H5OH + 3O2 2CO2 + 3H2O
- Phản ứng: 4NH3 + 5O2 → 4NO + 6H2O. Thường diễn ra trong quá trình điều chế HNO3
- Phản ứng hô hấp của cơ thể con người:
C6H12O6 + 6O2 6CO2 + 6H2O
a)
b)
Lời giải:
a)
- Xét hợp chất K2Cr2O7:
Đặt số oxi hóa của Cr là x ta có:
2.(+1) + 2.x + 7.(-2) = 0 ⇒ x = +6
Vậy số oxi hóa của Cr trong hợp chất K2Cr2O7 bằng +6.
- Xét hợp chất KMnO4
Đặt số oxi hóa của Mn là x ta có:
1.(+1) + 1.x + 4.(-2) = 0 ⇒ x = +7
Vậy số oxi hóa của Mn trong hợp chất KMnO4 bằng +7
- Xét hợp chất KClO4:
Đặt số oxi hóa của Cl là x ta có:
1.(+1) + 1.x + 4.(-2) = 0 ⇒ x = +7
Vậy số oxi hóa của Cl trong hợp chất KClO4 bằng +7
- Xét hợp chất NH4NO3
Đặt số oxi hóa của N được đánh dấu ∗ là x. Nhóm có điện tích +1 nên ta có
1.x + 4.(+1) = +1 ⇒ x = -3
Vậy số oxi hóa của nguyên tử N được đánh dấu ∗ là -3
b) - Xét ion . Đặt số oxi hóa của Al là x ta có:
1.x + 2.(-2) = -1 ⇒ x = +3
Vậy số oxi hóa của Al trong ion bằng +3
- Xét ion . Đặt số oxi hóa của P là x ta có:
1.x + 4.(-2) = -3 ⇒ x = +5
Vậy số oxi hóa của P trong ion bằng +5
- Xét ion . Đặt số oxi hóa của Cl là x ta có:
1.x + 3.(-2) = -1 ⇒ x = +5
Vậy số oxi hóa của Cl trong ion bằng +5
- Xét ion . Đặt số oxi hóa của S là x ta có:
1.x + 4.(-2) = -2 ⇒ x = +6
Vậy số oxi hóa của S trong ion bằng +6.
a) HCl + MnO2 MnCl2 + Cl2↑ + H2O
b) KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
c) Fe3O4 + HNO3 → Fe(NO3)3 + NO↑ + H2O
d) H2C2O2 + KMnO4 + H2SO4 → CO2↑ + MnSO4 + K2SO4 + H2O
Lời giải:
a) HCl + MnO2 MnCl2 + Cl2↑ + H2O
Bước 1:
Chất khử: HCl
Chất oxi hóa: MnO2
Bước 2: Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
b) KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
Bước 1:
Chất khử: KNO2
Chất oxi hóa: KMnO4
Bước 2: Quá trình khử:
Quá trình oxi hóa:
Bước 3:
Bước 4:
2KMnO4 + 5KNO2 + 3H2SO4 → 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
c) Fe3O4 + HNO3 → Fe(NO3)3 + NO↑ + H2O
Bước 1:
Chất khử: Fe3O4
Chất oxi hóa: HNO3
Bước 2: Quá trình khử:
Quá trình oxi hóa:
Bước 3:
Bước 4:
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑ + 14H2O
d) H2C2O2 + KMnO4 + H2SO4 → CO2↑ + MnSO4 + K2SO4 + H2O
Bước 1:
Chất khử: H2C2O2
Chất oxi hóa: KMnO4
Bước 2: Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
5H2C2O2 + 6KMnO4 + 9H2SO4 → 10CO2↑ + 6MnSO4 + 3K2SO4 + 14H2O
Bài 3 trang 79 Hóa học 10: Có nhiều hiện tượng xảy ra xung quanh ta, em hãy nêu hai phản ứng oxi hóa - khử gắn liền với cuộc sống hàng ngày và lập phương trình hóa học của các phản ứng đó bằng phương pháp thăng bằng electron.
Lời giải:
1. Sắt bị gỉ trong không khí ẩm là phản ứng oxi hóa khử
Quá trình oxi hóa: Fe → Fe2+ + 2e
Quá trình khử: 2H2O + O2 + 4e → 4OH-
Fe2+ tan vào dung dịch có hòa tan khí O2. Tại đây, Fe2+ tiếp tục bị oxi hóa, dưới tác dụng của ion OH- tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O (oxit sắt(III) ngậm n phân tử nước).
4Fe + 3O2 + nH2O 2Fe2O3.nH2O
2. Phản ứng oxi hóa hoàn toàn methane (thành phần chính của khí thiên nhiên)
CH4 + O2 CO2 + H2O
Bước 1:
Chất khử: CH4
Chất oxi hóa: O2
Bước 2: Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4: CH4 + 2O2 CO2 + 2H2O
Lời giải:
- Phản ứng oxi hóa - khử:
Zn + 2HCl → ZnCl2 + H2
- Phản ứng không phải là oxi hóa khử:
ZnSO4 + BaCl2 → ZnCl2 + BaSO4↓
Bài 5 trang 79 Hóa học 10: Nhiên liệu rắn dành cho tên lửa tăng tốc của tàu vũ trụ con thoi là hỗn hợp gồm ammonium perchlorate (NH4ClO4) và bột nhôm. Khi được đốt đến trên 200oC, ammonium perchlorate nổ theo phản ứng sau:
NH4ClO4 N2↑ + Cl2↑ + O2↑ + H2O↑
Lập phương trình hóa học của phản ứng bằng phương pháp thăng bằng electron.
Lời giải:
Bước 1:
NH4ClO4 vừa là chất khử vừa là chất oxi hóa.
Bước 2: Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
2NH4ClO4 N2 + Cl2 + 2O2 + 4H2O
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.