Với giải Câu hỏi trang 73 SGK Hoá học10 Chân trời sáng tạo trong Bài 12: Phản ứng oxi hoá - khử và ứng dụng trong cuộc sống giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Nội dung bài viết
Hoá học 10 Chân trời sáng tạo trang 73 Bài 12: Phản ứng oxi hoá - khử và ứng dụng trong cuộc sống
Câu hỏi 2 trang 73 Hóa học 10: Quan sát Hình 12.2a hydrogen cháy trong chlorine với ngọn lửa sáng, tạo hợp chất hydrogen chloride (HCl). Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl (Hình 12.2b), hãy xác định điện tích của các nguyên tử trong phân tử HCl
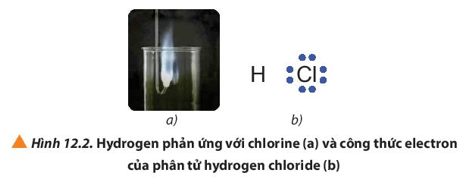
Lời giải:
Giả định nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl khi đó có thể coi Cl nhận 1 electron và H nhường 1 electron
⇒ Cl mang điện tích -1 và H mang điện tích +1
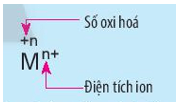
Lời giải:
Kí hiệu số oxi hóa: Dấu viết trước, số viết sau.
Kí hiệu điện tích ion: số viết trước, dấu viết sau.
Lời giải:
- Các nguyên tử nguyên tố nhóm IA đều có 1 electron lớp ngoài cùng, trong quá trình hình thành liên kết hóa học có xu hướng nhường đi 1 electron này để đạt được cấu hình electron bền vững của khí hiếm.
⇒ Các nguyên tử trong nhóm IA có số oxi hóa là +1
- Các nguyên tử nguyên tố nhóm IIA đều có 2 electron lớp ngoài cùng, trong quá trình hình thành liên kết hóa học có xu hướng nhường đi 2 electron này để đạt được cấu hình electron bền vững của khí hiếm.
⇒ Các nguyên tử trong nhóm IIA có số oxi hóa là +2
- Các nguyên tử nguyên tố nhóm IIIA đều có 3 electron lớp ngoài cùng, trong quá trình hình thành liên kết hóa học có xu hướng nhường đi 3 electron này để đạt được cấu hình electron bền vững của khí hiếm.
⇒ Các nguyên tử trong nhóm IIIA có số oxi hóa là +3.
Lời giải:
- Số oxi hóa của nguyên tử trong các đơn chất bằng 0
⇒ Số oxi hóa: 0Zn;0H2
- Đối với ion đơn nguyên tử, số oxi hóa của nguyên tử trong ion bằng điện tích của ion đó.
⇒ Số oxi hóa của nguyên tử Cl, O, S trong Cl‑, O2-, S2-lần lượt bằng -1; -2; -2.
- Đối với ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích của ion đó.
- Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, số oxi hóa của oxygen bằng -2.
⇒ Xét ion HSO4-
+ Số oxi hóa của H là +1, của O là -2
+ Số oxi hóa của S là x ta có: 1.(+1) + 1.x + 4.(-2) = -1 ⇒ x = +6
- Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0.
- Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1.
⇒ Xét phân tử Na2S2O3
+ Số oxi hóa của Na là +1
+ Số oxi hóa của O là -2
+ Số oxi hóa của S là x ta có: 2.(+1) + 2.x + 3.(-2) = 0 ⇒ x = +2
Xét phân tử KNO3
+ Số oxi hóa của K là +1
+ Số oxi hóa của O là -2
+ Số oxi hóa của N là x ta có: 1.(+1) + 1.x + 3.(-2) = 0 ⇒ x = +5
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Luyện tập trang 74 Hóa học 10: Magnetite là khoáng vật sắt từ có hàm lượng sắt cao nhất được dùng trong ngành luyện gang, thép, với công thức hóa học là Fe3O4. ..
Luyện tập trang 75 Hóa học 10: Cho phương trình hóa học của các phản ứng sau...
Câu hỏi 6 trang 76 Hóa học 10: Làm thế nào để biết một phản ứng là phản ứng oxi hóa – khử?...
Bài 5 trang 79 Hóa học 10: Nhiên liệu rắn dành cho tên lửa tăng tốc của tàu vũ trụ con thoi là hỗn hợp gồm ammonium perchlorate (NH4ClO4) và bột nhôm...
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.