Với Giải SBT Hóa học 10 trang 33 trong Bài 9: Liên kết ion Sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 trang 33.
Nội dung bài viết
SBT Hóa học 10 trang 33
Bài 9.13 trang 33 sách bài tập Hóa học 10: Cho biết lực hút tĩnh điện được tính theo công thức sau: (q1, q2) là giá trị điện tích của hai điện tích điểm, đơn vị là C (coulomb); r là khoảng cách giữa hai điện tích điểm; đơn vị là m (meter); k là hằng số coulomb). Dựa vào công thức trên, hãy so sánh gần đúng lực hút tĩnh điện giữa các ion trái dấu trong phân tử NaCl và phân tử MgO. Từ đó, cho biết nhiệt độ nóng chảy và nhiệt độ sôi của hợp chất nào cao hơn.
Lời giải:
Do phân tử NaCl có |q1| = |q2| = 1 đơn vị điện tích; phân tử MgO có |q1| = |q2| = 2 đơn vị điện tích, ngoài ra bán kính cation Mg2+ lại nhỏ hơn bán kính cation Na+ và bán kính anion O2- cũng nhỏ hơn bán kính anion Cl- nên liên kết trong MgO bền hơn nhiều so với trong NaCl. Điều này dẫn đến nhiệt độ nóng chảy và nhiệt độ sôi của MgO cao hơn nhiều so với NaCl.
Thực nghiệm cho thấy, NaCl nóng chảy ở 801oC và sôi ở 1413oC; MgO nóng chảy ở 2850oC và sôi ở 3600oC.
Bài 9.14 trang 33 sách bài tập Hóa học 10: Hình dạng và cấu trúc tinh thể của mọi hợp chất ion có giống nhau không? Giải thích.
Lời giải:
Do có sự khác nhau về kích thước và số lượng tương đối của các ion liên kết với nhau nên cấu trúc tinh thể của các hợp chất ion khác nhau sẽ có kích thước và hình dạng khác nhau.
Bài 9.15 trang 33 sách bài tập Hóa học 10: Vì sao các hợp chất ion thường tồn tại ở trạng thái rắn và cứng trong điều kiện thường, nhưng lại giòn, dễ vỡ?
Lời giải:
Do các hợp chất ion có cấu trúc tinh thể và lực hút tĩnh điện mạnh nên chúng thường tồn tại ở trạng thái rắn và cứng trong điều kiện thường. Tuy nhiên, chúng lại rất giòn do khi bị tác dụng bởi một lực, cứ một lớp ion bị khẽ dịch chuyển kéo theo toàn bộ sự sắp xếp sẽ bị xáo trộn do các ion trái dấu tự đẩy nhau, khiến mạng tinh thể bị vỡ.
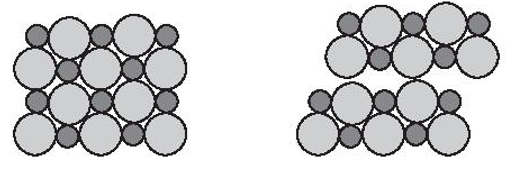
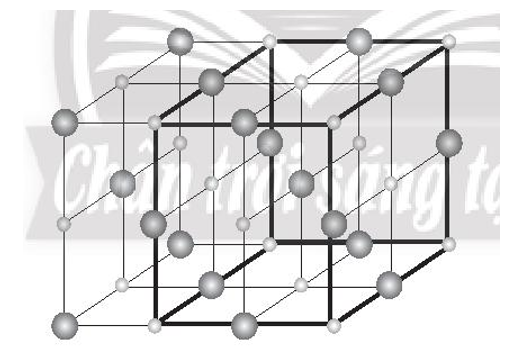
Bài 9.16 trang 33 sách bài tập Hóa học 10: Vì sao nói sodium chloride có cấu trúc mạng tinh thể kiểu lập phương tâm diện?
Lời giải:
Lập phương tâm diện (kí hiệu là FCC: face centered cubic) là cấu trúc lập phương với 8 ion (hoặc nguyên tử) nằm ở các đỉnh hình lập phương và 6 ion (hoặc nguyên tử) khác nằm ở tâm của các mặt của hình lập phương.
Tinh thể NaCl được coi là sự đan xen giữa một mạng lập phương tâm diện của các anion với một mạng lập phương tâm diện của các cation.
Xem thêm lời giải vở bài tập Hóa học lớp 10 Chân trời sáng tạo với cuộc sống hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.