Với Giải SBT Hóa học 10 trang 36 trong Bài 10: Liên kết cộng hóa trị Sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 trang 36.
Nội dung bài viết
SBT Hóa học 10 trang 36
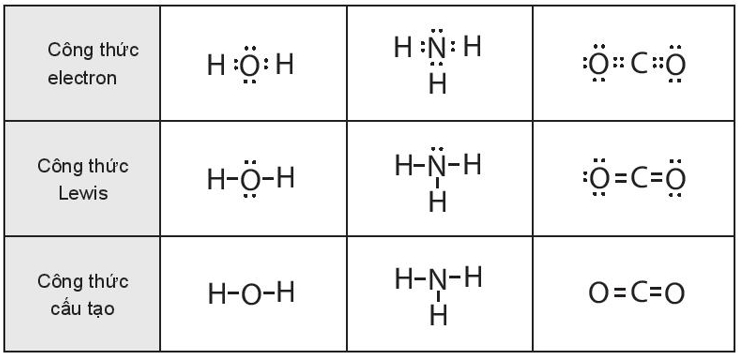
Bài 10.14 trang 36 sách bài tập Hóa học 10: Viết công thức electron, công thức Lewis và công thức cấu tạo của:
a. H2O
b. NH3
c. CO2
Lời giải:
Bài 10.15 trang 36 sách bài tập Hóa học 10: Ozone (O3) là một loại khí có tính oxi hóa mạng, phân tử gồm ba nguyên tử oxygen. Ozone xuất hiện ở tầng đối lưu và tầng bình lưu của khí quyển. Tùy thuộc vào vị trí của ozone trong các tầng trên mà nó ảnh hưởng đến sự sống trên Trái Đất theo các cách tốt, xấu khác nhau. Phân tử ozone có sự hiện diện liên kết cho – nhận. Viết công thức Lewis và công thức cấu tạo của ozone.
Lời giải:
Trong phân tử ozone có liên kết cho – nhận nên công thức Lewis và công thức cấu tạo của ozone lần lượt là:

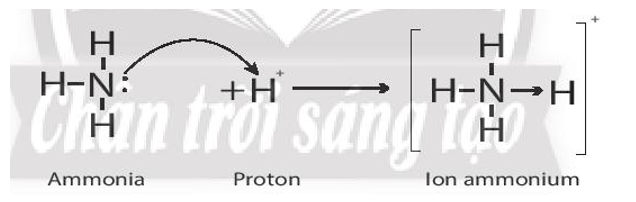
Bài 10.16 trang 36 sách bài tập Hóa học 10: Ammonium là chất thải của quá trình trao đổi chất ở động vật. Với cá và động vật không xương sống dưới nước, ion ammonium được bài tiết trực tiếp vào nước. Ở động vật có vú, cá mập và động vật lưỡng cư, ion ammonium được chuyển đổi trong chu trình urea thành urea (NH2)2CO. Ở chim, bò sát và ốc trên cạn, ion ammonium được chuyển hóa thành uric acid. Ion ammonium là nguồn cung cấp nitrogen quan trọng cho nhiều loài thực vật. Trình bày liên kết cho – nhận trong ion ammonium.
Lời giải:
Liên kết cho – nhận trong ion ammonium:
Trong phân tử NH3, lớp ngoài cùng của nguyên tử nitrogen có 5 electron, trong đó có cặp electron chưa liên kết. Ion H+ có AO trống, không có electron. Khi phân tử NH3 kết hợp với ion H+, nguyên tử nitrogen đóng góp cặp electron chưa liên kết để tạo liên kết với ion H+ tạo thành NH4+. Khi đó, liên kết cho – nhận được hình thành, trong phân tử NH3, nguyên tử nitrogen là nguyên tử cho, ion H+ đóng vai trò nhận electron. Trong ion NH4+, bốn liên kết N – H hoàn toàn tương đương nhau:
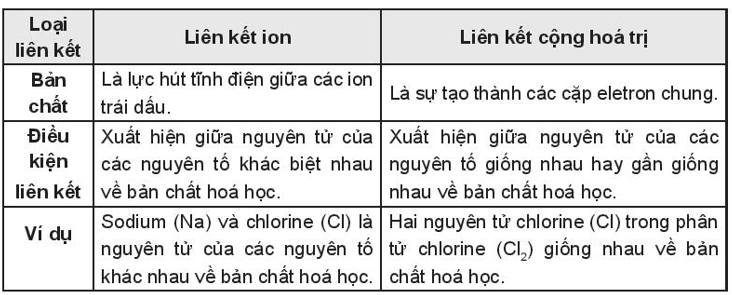
Bài 10.17 trang 36 sách bài tập Hóa học 10: Nhận xét điểm giống nhau và khác nhau giữa liên kết ion và liên kết cộng hóa trị. Cho ví dụ.
Lời giải:
- Giống nhau: Liên kết ion và liên kết cộng hóa trị đều là nguyên nhân giúp các nguyên tử hình thành nên phân tử, trong đó các nguyên tử trong phân tử đều đạt được cơ cấu bền vững của khí hiếm gần nhất. Ví dụ:
+ Liên kết ion là nguyên nhân hình thành liên kết giữa nguyên tử sodium và nguyên tử chlorine để tạo nên phân tử sodium chloride. Trong phân tử sodium chloride các nguyên tử sodium và chlorine đều đạt cơ cấu bền vững giống khí hiếm.
+ Liên kết cộng hóa trị là nguyên nhân hình thành liên kết giữa hai nguyên tử chlorine tạo nên phân tử chlorine. Trong phân tử chlorine, nguyên tử Cl đã đạt cơ cấu bền vững giống khí hiếm.
- Khác nhau:
Bài 10.18 trang 36 sách bài tập Hóa học 10: Hydrogen sulfide (H2S) là một chất khí không màu, mùi trứng thối, độc. Theo tài liệu của Cơ quan Quản lí an toàn và sức khỏe nghề nghiệp Hoa Kì, nồng độ H2S khoảng 100 ppm gây kích thích màng phổi. Nồng độ khoảng 400 – 700 ppm, H2S gây nguy hiểm đến tính mạng chỉ trong 30 phút. Nồng độ trên 800 ppm gây mất ý thức và nguy cơ làm tử vong ngay lập tức.
a. Viết công thức Lewis và công thức cấu tạo của H2S.
b. Em hiểu thế nào về nồng độ ppm của H2S trong không khí?
c. Một gian phòng trống (25oC; 1 bar) có kích thước 3m × 4m × 6m bị nhiễm 10 gam khí H2S. Tính nồng độ ppm của H2S trong gian phòng trên. Đánh giá mức độ độc hại của H2S trong trường hợp này. Cho biết 1 mol khí ở 25oC và 1 bar có thể tích 24,79 L.
Lời giải:
a) Công thức Lewis và công thức cấu tạo của H2S:

b) Nồng độ ppm (parts per million – thành phần phần triệu) của H2S trong không khí là số lít khí H2S có trong 1 000 000 L không khí.
Ví dụ nếu trong 1000 lít không khí có lẫn 0,1 lít H2S thì trong 1000000 lít không khí có
1000000.0,11000=1001000000.0,11000=100 lít H2S.
Ta nói nồng độ ppm của H2S trong không khí là 100 ppm.
c) Thể tích không khí = thể tích gian phòng = 3 . 4 . 6 = 72 m3.
Thể tích của 10 gam H2S = 24,79.1034=7,3L24,79.1034=7,3L
Trong 72 m3 không khí tức 72 000 lít không khí có 7,3 lít H2S nên trong 1000000 lít không khí có 1000000.7,372000=101,3891000000.7,372000=101,389lít H2S.
Vậy nồng độ H2S trong gian phòng là 101,38 ppm nên gây kích thích màng phổi.
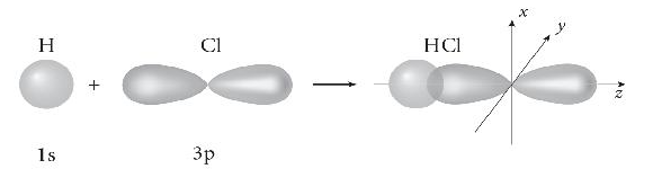
Bài 10.19 trang 36 sách bài tập Hóa học 10: Vẽ sơ đồ biểu diễn sự xen phủ giữa orbital 1s của nguyên tử hydrogen và orbital 3p của nguyên tử chlorine trong sự hình thành liên kết σ trong phân tử hydrogen chloride (HCl).
Lời giải:
Sơ đồ biểu diễn sự xen phủ giữa orbital 1s của nguyên tử hydrogen và orbital 3p của nguyên tử chlorine trong sự hình thành liên kết σ trong phân tử hydrogen chloride (HCl):
Bài 10.20 trang 36 sách bài tập Hóa học 10: Nhận xét mối tương quan giữa độ dài liên kết và năng lượng liên kết dựa theo bảng sau:
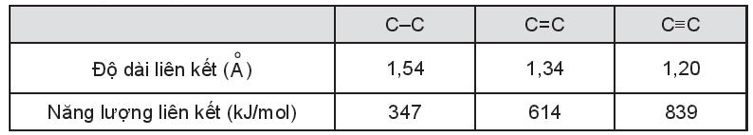
Lời giải:
Quan sát bảng ta thấy độ dài liên kết và năng lượng liên kết biến thiên tỉ lệ nghịch với nhau. Năng lượng liên kết càng lớn thì độ dài liên kết càng ngắn và ngược lại.
Xem thêm lời giải vở bài tập Hóa học lớp 10 Chân trời sáng tạo với cuộc sống hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.