Với Giải SBT Hóa học 10 trang 41 trong Bài 11: Liên kết hydrogen và tương tác van der waals Sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 trang 41.
Nội dung bài viết
SBT Hóa học 10 trang 41
Bài 11.12 trang 41 sách bài tập Hóa học 10: Giải thích vì sao các tương tác van der Waals giữa các phân tử có kích thước lớn lại mạnh hơn so với các phân tử có kích thước nhỏ.
Lời giải:
Phân tử có kích thước lớn thường đi đôi với nhiều electron. Chính vì vậy, khả năng tạo các ion lưỡng cực tức thời và lưỡng cực cảm ứng của các phân tử có kích thước lớn cũng nhiều hơn, từ đó tương tác van der Waals giữa các phân tử lớn cũng mạnh hơn so với các phân tử có kích thước nhỏ.
Bài 11.13 trang 41 sách bài tập Hóa học 10: Giải thích tại sao ở điều kiện thường, các nguyên tố trong nhóm halogen như fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
Lời giải:
Khi đi từ F2 đến I2, do khối lượng phân tử của các halogen tăng dần làm tương tác van der Waals giữa các phân tử halogen cũng tăng dần, kết quả các phân tử halogen “dính” với nhau chặt hơn, nên fluorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
Bài 11.14 trang 41 sách bài tập Hóa học 10: Nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố nhóm VA, VIA và VIIA được biểu diễn qua đồ thị sau:
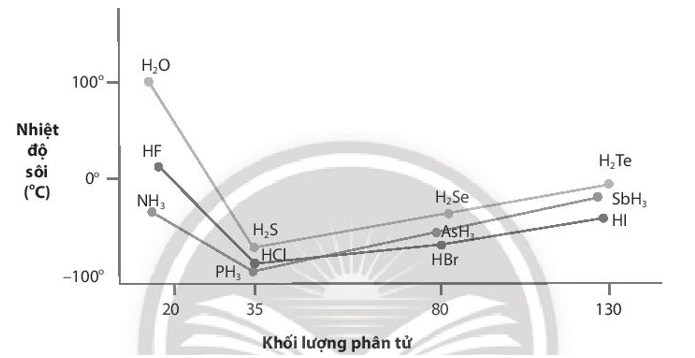
a. Giải thích nhiệt độ sôi cao bất thường của các hợp chất với hydrogen của các nguyên tố đầu tiên trong mỗi nhóm.
b. Nhận xét nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố còn lại ở mỗi nhóm và giải thích nguyên nhân sự biến đổi nhiệt độ sôi của chúng.
Lời giải:
a) Các nguyên tố đầu tiên trong mỗi nhóm VA, VIA, VIIA (N, O, F) có kích thước nhỏ và độ âm điện lớn, kết quả trong các hợp chất NH3; H2O; HF xuất hiện liên kết hydrogen liên phân tử làm cho các hợp chất này có nhiệt độ sôi cao bất thường so với các hợp chất còn lại trong mỗi nhóm.
b) Hợp chất với hydrogen của các nguyên tố còn lại trong mỗi nhóm có nhiệt độ sôi tăng dần khi khối lượng phân tử của chúng tăng. Vì khi khối lượng phân tử tăng, tương tác van der Waals giữa các phân tử trong hợp chất cũng tăng dẫn đến nhiệt độ sôi của chúng dần cao hơn.
Bài 11.15 trang 41 sách bài tập Hóa học 10: So sánh nhiệt độ nóng chảy và nhiệt độ sôi của pentane (CH3CH2CH2CH2CH3) và neopentane ((CH3)4C). Giải thích nguyên nhân sự khác biệt trên.
Lời giải:
Hai hợp chất pentane (CH3CH2CH2CH2CH3) và neopentane ((CH3)4C) có cùng công thức phân tử, tức cùng khối lượng phân tử. Tuy nhiên, phân tử neopentane có dạng hình cầu nên diện tích bề mặt tiếp xúc giữa các phân tử neopentane nhỏ hơn so với các phân tử pentane. Do đó, lực tương tác van der Waals giữa các phân tử pentane mạnh hơn giữa các phân tử neopentane nên nhiệt độ sôi và nhiệt độ nóng chảy của pentane cao hơn so với neopentane.
Thực nghiệm đã chứng minh:
Nhiệt độ sôi và nhiệt độ nóng chảy của pentane: -130oC và 36oC.
Nhiệt độ sôi và nhiệt độ nóng chảy của neopentane: -16,6oC và 9,5oC
Bài 11.16 trang 41 sách bài tập Hóa học 10: Giải thích vì sao tetrachloromethane (CCl4) tuy là phân tử không cực nhưng có nhiệt độ sôi cao hơn trichloromethane (CHCl3) là phân tử có cực.
Lời giải:
CHCl3 là một phân tử phân cực, trong khi CCl4 là một phân tử không phân cực. Như vậy, CHCl3 đáng lí phải có nhiệt độ sôi cao hơn CCl4. Tuy nhiên, thực tế CCl4 lại có nhiệt độ sôi cao là 76,8oC, cao hơn so với CHCl3 là 61,2oC. Điều này được giải thích do phân tử CCl4 có kích thước lớn hơn CHCl3 nên có số electron cũng nhiều hơn CHCl3, do đó tương tác van der Waals giữa các phân tử CCl4 mạnh hơn CHCl3, làm cho CCl4 có nhiệt độ sôi cao hơn CHCl3.
Xem thêm lời giải vở bài tập Hóa học lớp 10 Chân trời sáng tạo với cuộc sống hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.