Với giải Câu 3 trang 102 Hóa học lớp 10 Kết nối tri thức chi tiết trong Bài 20: Ôn tập chương VI giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Hydrogen peroxide phân huỷ theo phản ứng 2H2O2 → 2H2O + O2
Câu 3 trang 102 Hóa học 10: Hydrogen peroxide phân huỷ theo phản ứng 2H2O2 → 2H2O + O2.
Đo thể tích oxygen thu được theo thời gian, kết quả được ghi trong bảng sau:
|
Thời gian (min) |
0 |
15 |
30 |
45 |
60 |
|
Thể tích khí oxygen (cm3) |
0 |
16 |
30 |
40 |
48 |
a) Vẽ đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian.
b) Tính tốc độ trung bình của phản ứng (theo cm3/min) trong các khoảng thời gian:
- Từ 0 ÷ 15 phút; - Từ 15 ÷ 30 phút;
- Từ 30 ÷ 45 phút; - Từ 45 ÷ 60 phút.
Nhận xét sự thay đổi tốc độ trung bình theo thời gian.
Lời giải:
a) Đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian
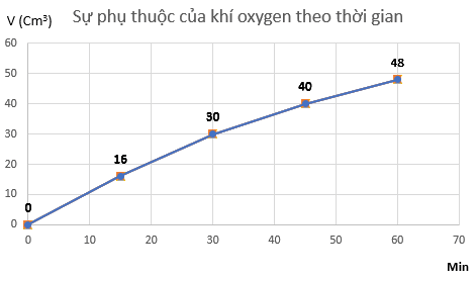 b) Tốc độ trung bình của phản ứng từ 0 ÷ 15 phút là:
b) Tốc độ trung bình của phản ứng từ 0 ÷ 15 phút là:
vtb=16−015−0=1,067 cm3/min
Tốc độ trung bình của phản ứng từ 15 ÷ 30 phút là:
vtb=30−1630−15=0,933
Tốc độ trung bình của phản ứng từ 30 ÷ 45 phút là:
vtb=40−3045−30=0,667 cm3/min
Tốc độ trung bình của phản ứng từ 45 ÷ 60 phút là:
vtb=48−4060−45=0,533 cm3/min
⇒ Tốc độ trung bình giảm dần theo thời gian.
Xem thêm các bài giải Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Xem thêm các bài giải SGK Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.