Toptailieu biên soạn và sưu tầm lời giải bài tập Hóa học lớp 10 Bài 20: Ôn tập chương VI sách Kết nối tri thức hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 20 từ đó học tốt môn Hóa học 10.
Nội dung bài viết
Hoá học 10 Kết nối tri thức Bài 20: Ôn tập chương 6
I. Hệ thống hoá kiến thức
II. Luyện tập
(a) Đốt cháy nhiên liệu.
(b) Sắt bị gỉ.
(c) Trung hoà acid - base.
Lời giải:
(a) Đốt cháy nhiên liệu: xảy ra với tốc độ nhanh.
(b) Sắt bị gỉ: xảy ra với tốc độ chậm.
(c) Trung hòa acid – base: xảy ra với tốc độ nhanh.
Câu 2 trang 102 Hóa học 10: Cho khoảng 2 g zinc (kẽm) dạng hạt vào một cốc đựng dung dịch H2SO4 2 M (dư) ở nhiệt độ phòng. Nếu chỉ biến đổi một trong các điều kiện sau đây (các điều kiện khác giữ nguyên) thì tốc độ phản ứng sẽ thay đổi thế nào (tăng lên, giảm xuống hay không đổi)?
(a) Thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều.
(b) Thay dung dịch H2SO4 2 M bằng dung dịch H2SO4 1 M có cùng thể tích.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50 °C).
Lời giải:
(a) Khi thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều thì tốc độ phản ứng tăng lên do tăng diện tích tiếp xúc của Zn.
(b) Khi thay dung dịch H2SO4 2 M bằng dung dịch H2SO4 1 M có cùng thể tích thì tốc độ phản ứng giảm do nồng độ acid giảm.
(c) Khi thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50 °C) thì tốc độ phản ứng tăng lên do số lần va chạm hiệu quả tăng.
Câu 3 trang 102 Hóa học 10: Hydrogen peroxide phân huỷ theo phản ứng 2H2O2 → 2H2O + O2.
Đo thể tích oxygen thu được theo thời gian, kết quả được ghi trong bảng sau:
|
Thời gian (min) |
0 |
15 |
30 |
45 |
60 |
|
Thể tích khí oxygen (cm3) |
0 |
16 |
30 |
40 |
48 |
a) Vẽ đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian.
b) Tính tốc độ trung bình của phản ứng (theo cm3/min) trong các khoảng thời gian:
- Từ 0 ÷ 15 phút; - Từ 15 ÷ 30 phút;
- Từ 30 ÷ 45 phút; - Từ 45 ÷ 60 phút.
Nhận xét sự thay đổi tốc độ trung bình theo thời gian.
Lời giải:
a) Đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian
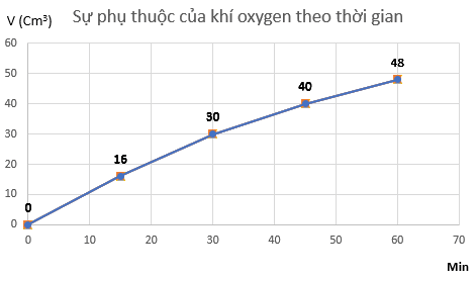 b) Tốc độ trung bình của phản ứng từ 0 ÷ 15 phút là:
b) Tốc độ trung bình của phản ứng từ 0 ÷ 15 phút là:
vtb=16−015−0=1,067 cm3/min
Tốc độ trung bình của phản ứng từ 15 ÷ 30 phút là:
vtb=30−1630−15=0,933
Tốc độ trung bình của phản ứng từ 30 ÷ 45 phút là:
vtb=40−3045−30=0,667 cm3/min
Tốc độ trung bình của phản ứng từ 45 ÷ 60 phút là:
vtb=48−4060−45=0,533 cm3/min
⇒ Tốc độ trung bình giảm dần theo thời gian.
Lời giải:
Chuẩn bị: Zn dạng viên, quỳ tím, sulfuric acid loãng, 2 ống nghiệm, đèn cồn, kẹp gỗ.
Tiến hành:
- Cho vào mỗi ống nghiệm khoảng 3 mL sulfuric acid loãng.
- Cho vào mỗi ống nghiệm mẩu quỳ tím và cho vào mỗi ống 1 viên Zn.
- Đun nóng 1 ống nghiệm.
Lưu ý: Làm sạch bề mặt Zn trước khi tiến hành thí nghiệm.
Hiện tượng:
- Ban đầu, khi cho quỳ tím vào 2 ống nghiệm thì quỳ tím chuyển sang màu đỏ.
- Ống nghiệm bị đun nóng thì quỳ tím nhạt màu nhanh chóng.
Phương trình hóa học:
Zn + 2HCl → ZnCl2 + H2
Câu 5 trang 102 Hóa học 10: Một phản ứng ở 45 °C có tốc độ là 0,068 mol/(L.min). Hỏi phải giảm xuống nhiệt độ bao nhiêu để tốc độ phản ứng là 0,017 mol/(L.min). Giả sử, trong khoảng nhiệt độ thí nghiệm, hệ số nhiệt độ Van't Hoff của phản ứng bằng 2.
Lời giải:
Mở rộng: vT+ 10avT=γa
⇒ 0,0680,017=2a ⇒ a = 2
⇒ T = 45 – 10.2 = 25 oC
⇒ Vậy phải giảm xuống đến 25 oC thì tốc độ phản ứng là 0,017 mol/(L.min)
Xem thêm các bài giải SGK Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.