Với giải Câu hỏi trang 48 SGK Hoá học10 Chân trời sáng tạo trong Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Chân trời sáng tạo trang 48 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm
Bài 2 trang 48 Hóa học 10: Bốn nguyên tố D, E, M, Q cùng thuộc một nhóm A trong bảng tuần hoàn, có số hiệu nguyên tử lần lượt là 9, 17, 35, 53. Các nguyên tố này được sắp xếp theo chiều tính phi kim tăng dần theo dãy nào sau đây?
A. D, Q, E, M
B. Q, M, E, D
C. D, E, M, Q
D. D, M, E, Q
Lời giải:
Đáp án đúng là: B
Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
⇒ Sắp xếp theo chiều tính phi kim tăng dần: Q, M, E, D.
Bài 3 trang 48 Hóa học 10: Xét ba nguyên tố có cấu hình electron lần lượt là:
X. 1s22s22p63s1
Q: 1s22s22p63s2
Z: 1s22s22p63s23p1
Tính base tăng dần của các hydroxide là:
A. XOH < Q(OH)2 < Z (OH)3
B. Z(OH)3 < XOH < Q (OH)2
C. Z(OH)3 < Q(OH)2 < XOH
D. XOH < Z(OH)2 < Q(OH)2
Lời giải:
Đáp án đúng là: C
Dựa vào cấu hình electron ta thấy các nguyên tố trên đều thuộc chu kì 3 trong bảng tuần hoàn.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần.
⇒ Sắp xếp theo chiều tính base tăng dần: Z(OH)3 < Q(OH)2 < XOH.
Lời giải:
Trong bảng tuần hoàn các nguyên tố hóa học nguyên tố F có tính phi kim mạnh nhất.
Vì trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính phi kim tăng dần. Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính phi kim giảm dần.
Nguyên tố flo nằm ở cuối chu kì 2 và đầu nhóm VIIA nên có tính phi kim mạnh nhất.
Bài 5 trang 48 Hóa học 10: Cho bảng số liệu sau:
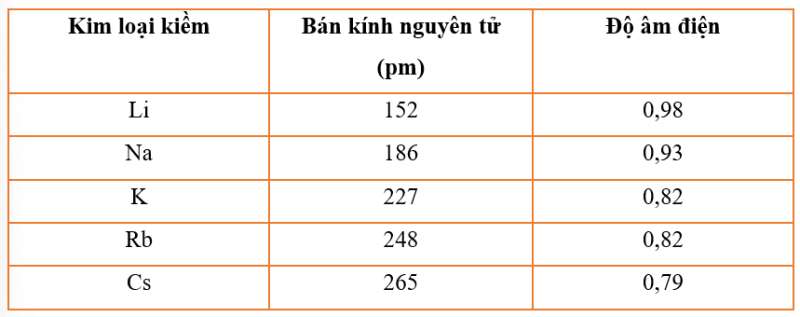 Hãy vẽ đồ thị hoặc biểu đồ với hai đại lượng bán kính nguyên tử và độ âm điện trong bảng bằng số liệu trên. Quan sát và cho biết hai đại lượng này biến thiên như thế nào? Giải thích
Hãy vẽ đồ thị hoặc biểu đồ với hai đại lượng bán kính nguyên tử và độ âm điện trong bảng bằng số liệu trên. Quan sát và cho biết hai đại lượng này biến thiên như thế nào? Giải thích
Lời giải:
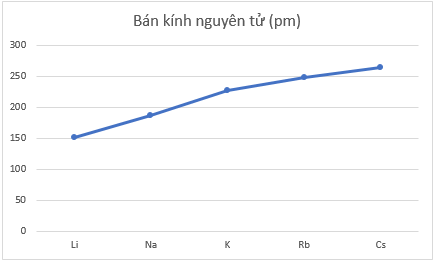
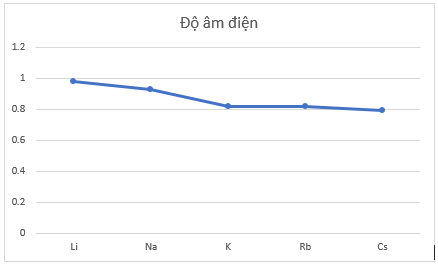
- Đồ thị với hai đại lượng bán kính nguyên tử và độ âm điện trong bảng bằng số liệu trên:
- Nhận xét:
Trong một nhóm:
+ Theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng do số lớp electron tăng.
+ Theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm. Vì số lớp electron tăng dần từ trên xuống dưới nên lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm nên độ âm điện giảm.
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 43 Hóa học 10: Kim loại kiềm là các kim loại nhóm IA, bao gồm: lithium (Li), sodium (Na), potassium (K), rubidium (Rb), caesium (Cs), francium (Fr)...
Câu hỏi 5 trang 45 Hóa học 10: Giải thích sự hình thành ion Na+ và ion F-...
Bài 1 trang 47 Hóa học 10: Nguyên tử của nguyên tố nào sau đây có bán kính nhỏ nhất?...
Bài 3 trang 48 Hóa học 10: Xét ba nguyên tố có cấu hình electron lần lượt là...
Bài 5 trang 48 Hóa học 10: Cho bảng số liệu sau...
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hoá học
Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.