Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố , thành phần và một số tính chất của hợp chất trong một chu kì và nhóm Chân trời sáng tạo (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố , thành phần và một số tính chất của hợp chất trong một chu kì và nhóm Chân trời sáng tạo (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Bán kính nguyên tử
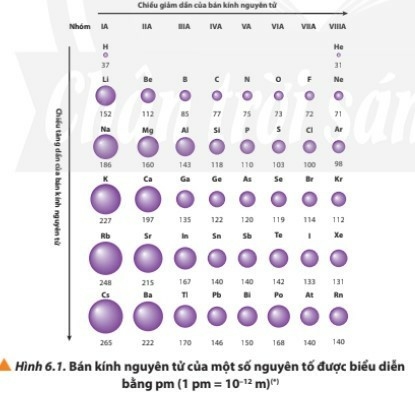
- Bán kính nguyên tử của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, nguyên tử của các nguyên tố có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên electron lớp ngoài cùng sẽ bị hạt nhân hút mạnh hơn, vì vậy bán kính nguyên tử của các nguyên tố có xu hướng giảm dần.
+ Trong một nhóm, theo chiều từ trên xuống dưới, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng.
II. Độ âm điện
- Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học.
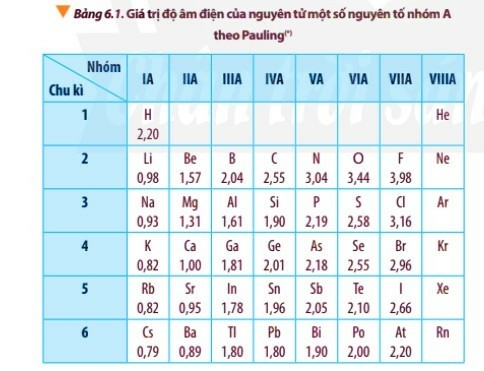
- Độ âm điện của nguyên tử các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
III. Tính kim loại, tính phi kim
- Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhường electron.
Ví dụ: Na → Na+ + 1e
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử dễ nhận electron.
Ví dụ: F + 1e → F-
- Tính kim loại, tính phi kim của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với electron lớp ngoài cùng tăng. Do đó, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
IV. Tính acid – base của oxide và hydroxyde
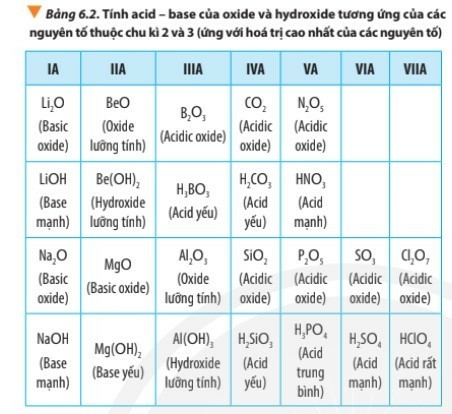
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần.
Bài tập
Câu 1. So sánh tính kim loại của Na, Mg, K đúng là
A. Na > Mg > K
B. K > Mg > Na
C. Mg > Na > K
D. K > Na > Mg
Đáp án: D
Cấu hình electron của Na (Z = 11): 1s22s22p63s1 ⇒ chu kì 3, nhóm IA
Cấu hình electron của Mg (Z = 12): 1s22s22p63s2 ⇒ chu kì 3, nhóm IIA
Cấu hình electron của K (Z = 19): [Ar]4s1 ⇒ chu kì 4, nhóm IA
Trong một chu kì, theo chiều điện tích hạt nhân tăng, tính kim loại giảm dần.
Na, Mg thuộc chu kì 3 theo chiều điện tích hạt nhân tăng ⇒ tính kim loại Na > Mg
Trong một nhóm, theo điện tích hạt nhân tăng dần, tính kim loại tăng dần.
Na, K cùng thuộc nhóm IA theo chiều điện tích hạt nhân tăng dần ⇒ tính kim loại của Na < K.
Vậy tính kim loại của K > Na > Mg.
Câu 2. So sánh tính phi kim của F, S, Cl đúng là
A. F > S > Cl
B. Cl > S > F
C. F > Cl > S
D. S > Cl > F
Đáp án: C
Cấu hình electron của F (Z = 9): 1s22s22p5 ⇒ chu kì 2, nhóm VIIA
Cấu hình electron của S (Z = 16): 1s22s22p63s23p4 ⇒ chu kì 3, nhóm VIA
Cấu hình electron của Cl (Z = 17): 1s22s22p63s23p5 ⇒ chu kì 3, nhóm VIIA
Trong một chu kì, theo chiều điện tích hạt nhân tăng, tính phi kim tăng dần.
S, Cl thuộc chu kì 3 theo chiều điện tích hạt nhân tăng ⇒ tính phi kim S < Cl
Trong một nhóm, theo điện tích hạt nhân tăng dần, tính phi kim giảm dần.
F, Cl cùng thuộc nhóm VIIA theo chiều điện tích hạt nhân tăng dần ⇒ tính phi kim của F > Cl.
Vậy tính phi kim của F > Cl > S.
Câu 3. Theo độ âm điện của Pauling, nguyên tử có độ âm điện lớn nhất trong bảng tuần hoàn là
A. F
B. H
C. He
D. O
Đáp án: A
Theo độ âm điện của Pauling, nguyên tử có độ âm điện lớn nhất trong bảng tuần hoàn là F với độ âm điện là 3,98.
Câu 4. Sắp xếp tính base của NaOH, Mg(OH)2, Al(OH)3 theo chiều giảm dần là
A. NaOH, Mg(OH)2, Al(OH)3
B. Al(OH)3, Mg(OH)2, NaOH
C. Mg(OH)2, Al(OH)3, NaOH
D. Mg(OH)2, NaOH, Al(OH)3
Đáp án: A
Na, Mg, Al cùng thuộc chu kì 3 theo chiều tăng dần của điện tích hạt nhân, tính base của hydroxide có xu hướng giảm dần theo thứ tự NaOH, Mg(OH)2, Al(OH)3.
Câu 5. Nguyên tử của nguyên tố nào sau đây có bán kính nguyên tử lớn nhất?
A. Si (Z = 14)
B. P (Z = 15)
C. Ge (Z = 32)
D. As (Z = 33)
Đáp án: C
Si (Z = 14) có cấu hình electron là: [Ne]3s23p2 ⇒ Chu kì 3, nhóm IVA
P (Z = 15) có cấu hình electron là: [Ne]3s23p3 ⇒ Chu kì 3, nhóm VA
Ge (Z = 32) có cấu hình electron là: [Ar]3d104s24p2 ⇒ Chu kì 4, nhóm IVA
As (Z = 33) có cấu hình electron là: [Ar]3d104s24p3 ⇒ Chu kì 4, nhóm VA
Trong một chu kì, theo chiều từ trái sang phải, bán kính nguyên tử giảm dần.
Si; P cùng thuộc chu kì 3 theo chiều từ trái sang phải ⇒ bán kính nguyên tử của Si > P.
Ge, As cùng thuộc chu kì 4 theo chiều từ trái sang phải ⇒ bán kính nguyên tử của Ge > As.
Trong một nhóm, theo điện tích hạt nhân tăng dần, bán kính nguyên tử tăng dần.
Si, Ge cùng thuộc nhóm IVA theo chiều điện tích hạt nhân tăng dần ⇒ bán kính nguyên tử Si < Ge
Vậy bán kính nguyên tử Ge > As và Ge > Si > P.
Nguyên tử của nguyên tố Ge có bán kính nguyên tử lớn nhất.
Câu 6. Từ thích hợp điền vào chỗ trống là
“Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử của các nguyên tố có xu hướng …….., độ âm điện của nguyên tử các nguyên tố có xu hướng ………”
A. tăng dần, tăng dần
B. tăng dần, giảm dần
C. giảm dần, giảm dần
D. giảm dần, tăng dần
Đáp án: D
Quy luật chung đối với các nguyên tố nhóm A:
Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử của các nguyên tố có xu hướng giảm dần, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
Câu 7. Cho các phát biểu sau:
(1) Trong một nhóm A, theo chiều từ trên xuống dưới, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng.
(2) Trong một nhóm A, theo chiều từ dưới lên trên, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng.
(3) Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, lực hút của hạt nhân với các electron lớp ngoài cùng tăng. Do đó độ âm điện có xu hướng tăng dần.
(4) Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút của hạt nhân với các electron lớp ngoài cùng giảm. Do đó độ âm điện có xu hướng giảm dần.
Phát biểu đúng là:
A. (1) và (3)
B. (1) và (4)
C. (2) và (3)
D. (2) và (4)
Đáp án: B
Phát biểu đúng là:
(1) Trong một nhóm A, theo chiều từ trên xuống dưới, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng.
(4) Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút của hạt nhân với các electron lớp ngoài cùng giảm. Do đó độ âm điện có xu hướng giảm dần.
Câu 8. Sắp xếp các nguyên tố sau đây theo chiều tăng dần bán kính nguyên tử: Li, N, O, Na, K.
A. Li, N, O, Na, K
B. K, Na, O, N, Li
C. O, N, Li, Na, K
D. O, N, Li, K, Na
Đáp án: C
Cấu hình electron của Li (Z = 3): 1s22s1 ⇒ chu kì 2, nhóm IA
Cấu hình electron của N (Z = 7): 1s22s22p3 ⇒ chu kì 2, nhóm VA
Cấu hình electron của O (Z = 8): 1s22s22p4 ⇒ chu kì 2, nhóm VIA
Cấu hình electron của Na (Z = 11): 1s22s22p63s1 ⇒ chu kì 3, nhóm IA
Cấu hình electron của K (Z = 19): [Ar]4s1 ⇒ chu kì 4, nhóm IA
Trong một chu kì, theo chiều từ trái sang phải, bán kính nguyên tử giảm dần.
Li; N và O cùng thuộc chu kì 2 theo chiều từ trái sang phải ⇒ bán kính nguyên tử của Li > N > O.
Trong một nhóm, theo điện tích hạt nhân tăng dần, bán kính nguyên tử tăng dần.
Li, Na, K cùng thuộc nhóm IA theo chiều điện tích hạt nhân tăng dần ⇒ bán kính nguyên tử Li < Na < K.
Vậy bán kính nguyên tử xếp theo thứ tự tăng dần là: O, N, Li, Na, K
Câu 9. Sắp xếp các nguyên tố sau đây theo chiều tăng dần độ âm điện: Na, K, Mg, Al.
A. Al, Mg, Na, K
B. K, Na, Mg, Al
C. Na, Mg, Al, K
D. K, Al, Mg, Na
Đáp án: B
Cấu hình electron của Na (Z = 11): 1s22s22p63s1 ⇒ chu kì 3, nhóm IA
Cấu hình electron của Mg (Z = 12): 1s22s22p63s2 ⇒ chu kì 3, nhóm IIA
Cấu hình electron của Al (Z = 13): 1s22s22p63s23p1 ⇒ chu kì 3, nhóm IIIA
Cấu hình electron của K (Z = 19): [Ar]4s1 ⇒ chu kì 4, nhóm IA
Trong một chu kì, theo chiều từ trái sang phải, độ âm điện tăng dần.
Na, Mg và Al cùng thuộc chu kì 3 theo chiều từ trái sang phải ⇒ độ âm điện của Na < Mg < Al.
Trong một nhóm, theo điện tích hạt nhân tăng dần, độ âm điện giảm dần.
Na, K cùng thuộc nhóm IA theo chiều điện tích hạt nhân tăng dần ⇒ độ âm điện Na > K.
Vậy độ âm điện xếp theo thứ tự tăng dần là: K, Na, Mg, Al.
Câu 10. Khẳng định sai là
A. Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhường electron
B. Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhận electron
C. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần
D. Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần
Đáp án: D
Khẳng định D sai vì: Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
Câu 11. Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố có tính phi kim mạnh nhất là
A. Iodine (I)
B. Hydogen (H)
C. Caesium (Cs)
D. Fluorine (F)
Đáp án: D
Trong một chu kì, theo chiều từ trái sang phải (chiều tăng dần điện tích hạt nhân) tính phi kim tăng dần. Do đó các nguyên tố ở cuối chu kì sẽ có tính phi kim mạnh.
⇒ Mà nhóm cuối chu kì là VIIIA (khí hiếm) nên nguyên tố có tính phi kim mạnh nhất sẽ nằm ở nhóm VIIA.
Mặt khác, trong một nhóm theo chiều từ trên xuống dưới (chiều tăng của điện tích hạt nhân) tính phi kim giảm dần. Do đó nguyên tố ở đầu nhóm VIIA có tính phi kim mạnh nhất.
Nguyên tố đầu nhóm VIIA là fluorine (F).
Vậy trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố có tính phi kim mạnh nhất là fluorine (F).
Câu 12. Các chất H2SiO3, HClO4, H2SO4 và H3PO4 được sắp xếp theo chiều giảm dần tính acid là
A. H2SiO3, HClO4, H2SO4, H3PO4
B. H2SiO3, H3PO4, H2SO4, HClO4
C. HClO4, H2SO4, H3PO4, H2SiO3
D. H2SO4, H3PO4, H2SiO3, HClO4
Đáp án: C
Si, P, S, Cl cùng thuộc chu kì 3 theo chiều tăng dần của điện tích hạt nhân, tính acid của hydroxide có xu hướng tăng dần ⇒ tính acid H2SiO3 < H3PO4 < H2SO4 < HClO4
Thứ tự giảm dần là: HClO4, H2SO4, H3PO4, H2SiO3.
Câu 13. Trong các hydroxide dưới đây. Hydroxide lưỡng tính là
A. Al(OH)3
B. Mg(OH)2
C. NaOH
D. LiOH
Đáp án: A
Al(OH)3 là hydroxide lưỡng tính
Al(OH)3 thể hiện tính acid khi tác dụng với base
Al(OH)3 + NaOH ⟶ Na[Al(OH)4]
Al(OH)3 thể hiện tính base khi tác dụng với acid.
Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2O
Câu 14. Khẳng định nào dưới đây sai khi nói về các nguyên tố nhóm A?
A. Theo chiều tăng dần của điện tích hạt nhân, tính kim loại của nguyên tử nguyên tố hóa học có xu hướng giảm trong cùng một nhóm và tăng trong cùng một chu kì.
B. Theo chiều tăng dần của điện tích hạt nhân, tính phi kim của nguyên tử nguyên tố hóa học có xu hướng giảm trong cùng một nhóm và tăng trong cùng một chu kì.
C. Theo chiều tăng dần của điện tích hạt nhân, tính acid của oxide và hydroxide có xu hướng tăng dần trong một chu kì.
D. Theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide có xu hướng giảm dần trong một chu kì.
Đáp án: A
- Theo chiều tăng dần của điện tích hạt nhân, tính kim loại của nguyên tử nguyên tố hóa học có xu hướng tăng trong cùng một nhóm và giảm trong cùng một chu kì. ⇒ Khẳng định A sai.
- Theo chiều tăng dần của điện tích hạt nhân, tính phi kim của nguyên tử nguyên tố hóa học có xu hướng giảm trong cùng một nhóm và tăng trong cùng một chu kì.
- Theo chiều tăng dần của điện tích hạt nhân, tính acid của oxide và hydroxide có xu hướng tăng dần trong một chu kì.
- Theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide có xu hướng giảm dần trong một chu kì.
Câu 15. Đại lượng đặc trưng cho khả năng hút electron của một nguyên tử khi tạo thành liên kết hóa học là
A. bán kính nguyên tử;
B. độ âm điện;
C. năng lượng ion hóa;
D. điện tích hạt nhân.
Đáp án: B
Đại lượng đặc trưng cho khả năng hút electron của một nguyên tử khi tạo thành liên kết hóa học là độ âm điện.
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Cấu tạo bảng tuần hoàn của các nguyên tố hóa học
Bài 7: Định luật tuần hoàn. ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.