Toptailieu.vn biên soạn và giới thiệu Top 50 Đề thi Giữa học kì 2 Hóa học 10 (Kết nối tri thức 2024) tải nhiều nhất gồm các đề thi được tuyển chọn và tổng hợp từ các đề thi môn Hóa học THPT trên cả nước có hướng dẫn giải chi tiết giúp học sinh làm quen với các dạng đề, ôn luyện để đạt kết quả cao trong kì thi sắp tới. Mời các bạn đón xem:
Top 50 Đề thi Giữa học kì 2 Hóa học 10 (Kết nối tri thức 2024) tải nhiều nhất
Ma trận đề thi giữa học kì 2 Hóa học lớp 10 (Chân trời sáng tạo)
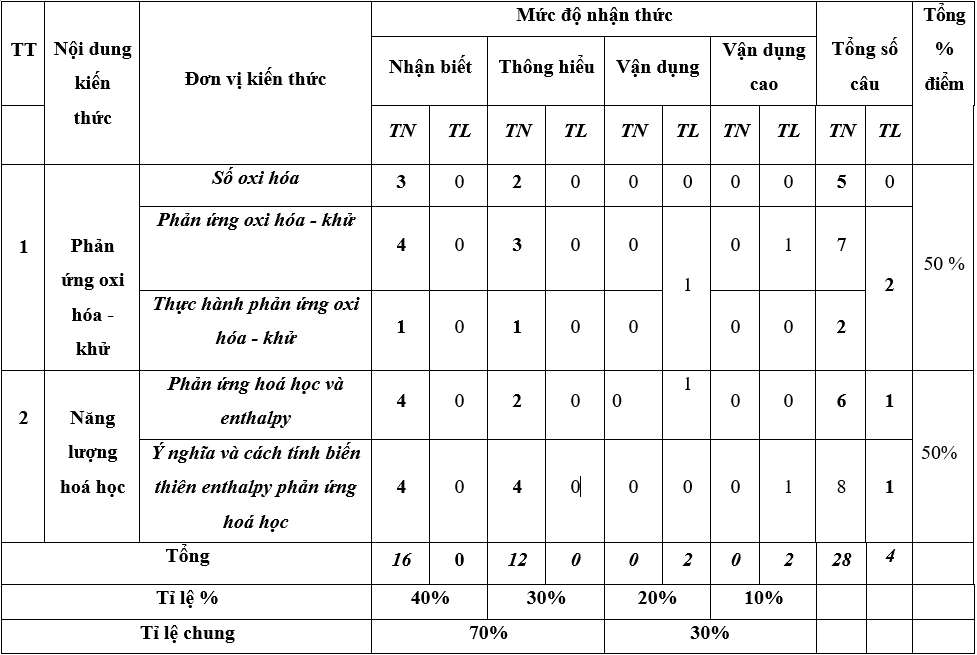 Bảng đặc tả kĩ thuật đề kiểm tra giữa kì 2 – Hoá 10 – Chân trời sáng tạo
Bảng đặc tả kĩ thuật đề kiểm tra giữa kì 2 – Hoá 10 – Chân trời sáng tạo
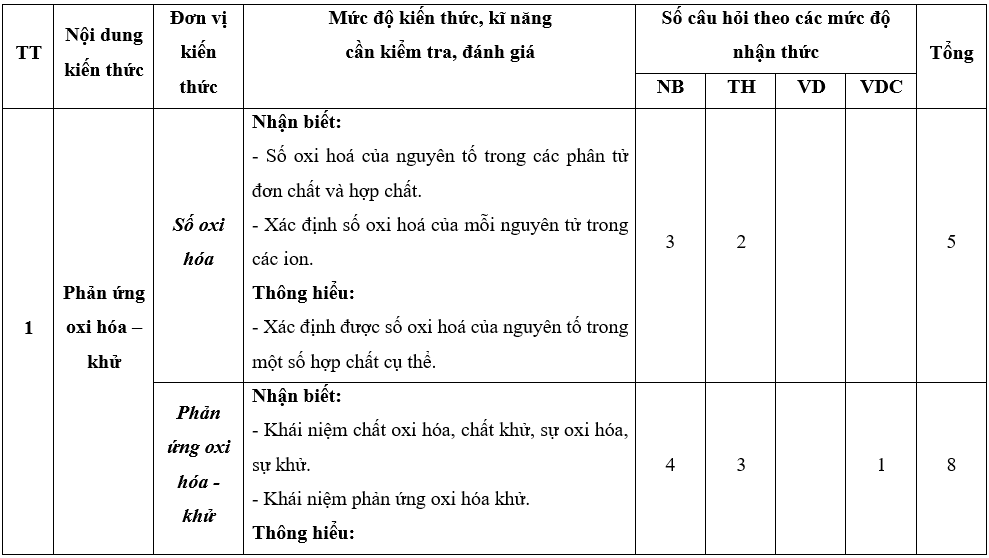
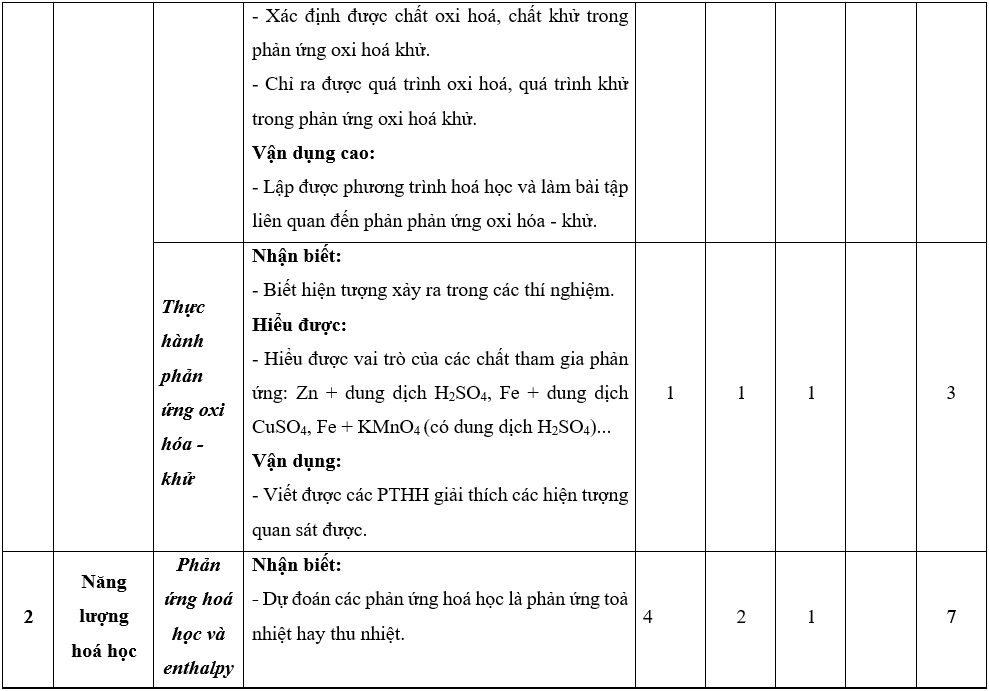
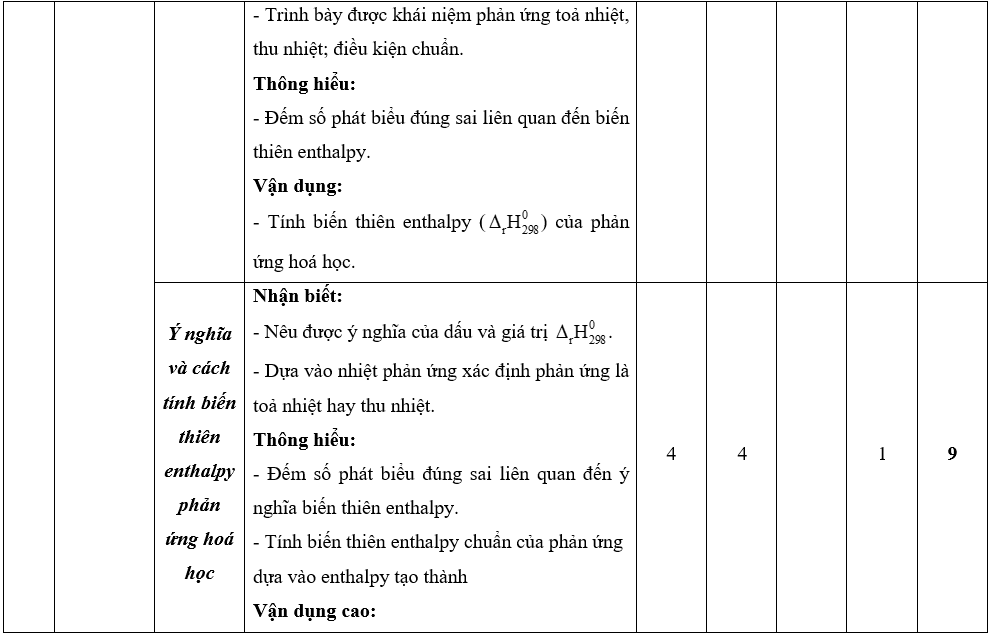

Lưu ý:
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 70% trắc nghiệm, 30% tự luận).
- Cấu trúc:
+ Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
+ Phần trắc nghiệm: 28 câu, 7,0 điểm (gồm 16 câu ở mức độ nhận biết;12 câu ở mức độ thông hiểu), mỗi câu 0,25 điểm;
+ Phần tự luận: 3,0 điểm (Vận dụng: 02 câu, 2,0 điểm; Vận dụng cao: 1-2 câu, 1,0 điểm).
- Các câu hỏi ở mức độ nhận biết và thông hiểu là các câu hỏi trắc nghiệm khách quan 4 lựa chọn, trong đó có duy nhất 1 lựa chọn đúng; các câu hỏi ở mức độ vận dụng và vận dụng cao là các câu hỏi tự luận.
- Với các câu hỏi TNKQ ở mức độ nhận biết và mức độ thông hiểu, mỗi câu hỏi kiểm tra, đánh giá 01 yêu cầu cần đạt của chương trình.
- Không chọn câu ở mức độ vận dụng và câu ở mức độ vận dụng cao trong cùng một đơn vị kiến thức.
Đề thi giữa học kì 2 Hóa học lớp 10 Chân trời sáng tạo có đáp án năm 2023 - Đề 1
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa Học kì 2
Năm học 2022 - 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
|
Sở GD- ĐT … TRƯỜNG THPT …
Mã đề thi: 001
|
ĐỀ KIỂM TRA GIỮA HỌC KÌ II Năm học 2022 - 2023 Môn: Hóa học 10 Bộ: Chân trời sáng tạo Thời gian làm bài: 45 phút; (28 câu trắc nghiệm – 3 câu tự luận) |
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:..................................................................... Lớp: .............................
Đề bài:
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Phản ứng hoá học xảy ra trong thí nghiệm nào sau đây là phản ứng oxi hoá – khử?
A. Cho mẩu đá vôi vào dung dịch HCl.
B. Nhiệt phân Mg(OH)2 thì thu được MgO màu trắng.
C. Cho kim loại Al tác dụng với dung dịch HCl có khí thoát ra.
D. Nhỏ dung dịch AgNO3 vào dung dịch HCl thấy có kết tủa trắng.
Câu 2: Quy tắc xác định số oxi hoá nào sau đây là không đúng?
A. Trong đa số các hợp chất, số oxi hoá của hydrogen là +1.
B. Kim loại kiềm (nhóm IA) luôn có số oxi hoá +1 trong hợp chất.
C. Oxygen luôn có số oxi hoá là -2.
D. Trong hợp chất, fluorine có số oxi hoá là –1.
Câu 3: Số oxi hoá của phosphorus trong hợp chất PH3 là
A. -3. B. +3.
C. -5. D. +5.
Câu 4: Số oxi hoá của nitrogen trong hợp chất NH4+ là
A. -4. B. +4.
C. -3. D. +3.
Câu 5: Sulfur trong hợp chất nào sau đây có số oxi hoá là +4?
A. H2S. B. SO3.
C. H2SO4. D. Na2SO3.
Câu 6: Cho các hợp chất sau: FeO; FeCl2; Fe(OH)3; Fe2O3; FeSO4. Số hợp chất trong đó sắt có số oxi hoá +2 là
A. 1. B. 2.
C. 4. D. 3.
Câu 7: Cho phương trình hoá học sau: 2H2S + 3O2 → 2SO2 + 2H2O. Chất khử trong phương trình hoá học là
A. O2. B. H2S.
C. SO2. D. H2O.
Câu 8: Chất bị oxi hoá là
A. chất nhường electron.
B. chất nhận electron.
C. chất có số oxi hoá giảm xuống sau phản ứng.
D. chất có số oxi hoá không thay đổi sau phản ứng.
Câu 9: Copper(II) oxide (CuO) bị khử bởi ammonia (NH3) theo phản ứng sau:
Tổng hệ số cân bằng (tối giản) của phản ứng là?
A. 11. B. 12.
C. 13. D. 14.
Câu 10: Nguyên tử carbon trong trường hợp nào sau đây vừa thể hiện tính khử, vừa thể hiện tính oxi hoá khi tham gia phản ứng hoá học?
A. C.
B. CO2.
C. CaCO3.
D. CH4.
Câu 11: Cho các phản ứng sau:
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
(d) 2HCl + Zn → ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2. B. 3.
C. 1. D. 4.
Câu 12: Cho 6,4 gram Cu tác dụng hết với lượng dư dung dịch H2SO4 đặc, nóng thu được V lít khí SO2 ở điều kiện chuẩn. Giá trị của V là
A. 4,958. B. 2,479.
C. 3,720. D. 0,297.
Câu 13: Cho đinh sắt vào ống nghiệm chứa 3 ml HCl, sắt phản ứng với HCl theo phương trình hoá học sau: Fe + 2HCl → FeCl2 + H2. Nhận xét nào sau đây là đúng?
A. Fe nhường electron nên là chất bị khử.
B. Ion H+ nhận electron nên là chất oxi hoá.
C. Quá trình oxi hoá:
D. Quá trình khử: .
Câu 14: Cho phương trình hóa học: aAl + bH2SO4 → cAl2(SO4)3 + dSO2 + eH2O.
Tỉ lệ a : b là
A. 1 : 1.
B. 2 : 3.
C. 1 : 3.
D. 1 : 2.
Câu 15: Cho các phản ứng sau:
(a) Phản ứng nhiệt phân Cu(OH)2 tạo thành CuO.
(b) Phản ứng trung hoà (acid tác dụng với base).
(c) Phản ứng nung clinker xi măng.
(d) Phản ứng oxi hoá glucose trong cơ thể.
Số phản ứng thu nhiệt là
A. 1. B. 2.
C. 3. D. 4.
Câu 16: Cho phản ứng sau:
2H2(g) + O2(g) → 2H2O(g)
Enthalpy tạo thành chuẩn của H2O(g) là
A. – 483,64 kJ/ mol.
B. 483,64 kJ/ mol.
C. – 241,82 kJ/ mol.
D. 241,82 kJ/ mol.
Câu 17: Cho các phản ứng sau:
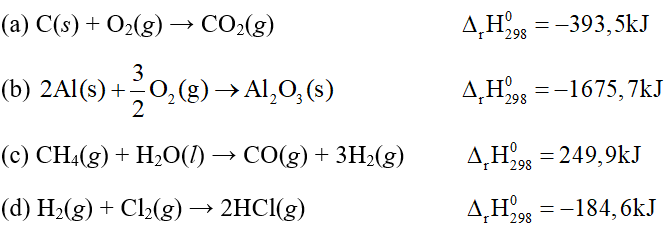 Số phản ứng toả nhiệt là
Số phản ứng toả nhiệt là
A. 4. B. 3.
C. 2. D. 1.
Câu 18: Cho giản đồ sau:
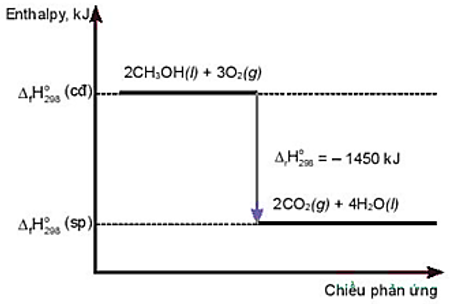
Phát biểu đúng là
A. Phản ứng thu nhiệt.
B. Nhiệt lượng thu vào của phản ứng là – 1450 kJ.
C. Phản ứng cần cung cấp nhiệt liên tục.
D. Nhiệt lượng toả ra của phản ứng là 1450 kJ.
Câu 19: Nhiệt kèm theo (nhiệt lượng toả ra hay thu vào) của một phản ứng hoá học ở áp suất không đổi (và thường ở một nhiệt độ xác định) gọi là
A. enthalpy tạo thành chuẩn của một chất.
B. enthalpy tạo thành của một chất.
C. biến thiên enthalpy chuẩn của phản ứng hoá học.
D. biến thiên enthalpy của phản ứng.
Câu 20: Cho phản ứng hoá học sau: 2Na(s) + Cl2(g) → 2NaCl(s). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
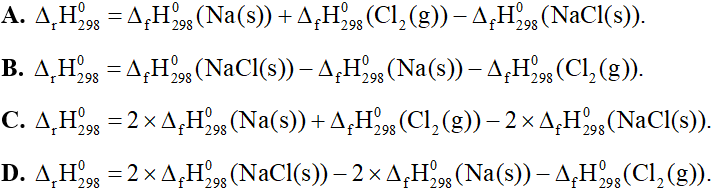
Câu 21: Cho phản ứng sau: CaCO3(s) → CaO(s) + CO2(g).
Ở điều kiện chuẩn, biến thiên enthalpy của phản ứng là (Biết nhiệt tạo thành (kJ/mol) của CaCO3, CaO và CO2 lần lượt là -1 207, -635 và -393,5)
A. +178,5 kJ. B. -178,5 kJ.
C. + 357 kJ. D. -357 kJ.
Câu 22: Cho các phát biểu sau:
(a). Tất cả các phản ứng cháy đều toả nhiệt.
(b). Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(c). Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều toả nhiệt.
(d). Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
(e). Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng.
(g). Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,...) là những ví dụ về phản ứng thu nhiệt vì cần phải khơi mào.
Số phát biểu đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 23: Phát biểu nào sau đây đúng?
A. Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol/ L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
B. Điều kiện chuẩn là điều kiện ứng với nhiệt độ 298 K.
C. Áp suất 760 mmHg là áp suất ở điều kiện chuẩn.
D. Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm, nhiệt độ 0 °C.
Câu 24: Phản ứng luyện gang trong lò cao xảy ra theo sơ đồ sau:
Fe2O3(s) + CO(g) Fe(s) + CO2(g)
Từ 1 mol Fe2O3 và 1 mol CO, giả sử chỉ xảy ra phản ứng theo sơ đồ trên với hiệu suất 100% thì giải phóng một lượng nhiệt là (Biết nhiệt tạo thành chuẩn của Fe2O3; CO; Fe; CO2 (kJ/ mol) lần lượt là -824,2; -110,5; 0 và -393,5)
A. 8,27 kJ.
B. 49,6 kJ.
C. 12,4 kJ.
D. 74,4 kJ.
Câu 25: Cho phản ứng hóa học sau: CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
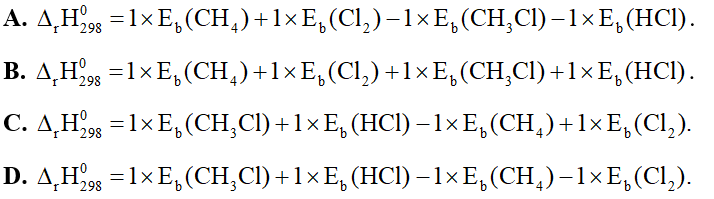
Câu 26: Cho phản ứng sau: H2(g) + Cl2(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng là
Biết: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol.
A. +158 kJ.
B. -158 kJ.
C. +185 kJ.
D. -185 kJ.
Câu 27: Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
A. Phản ứng nhiệt phân KClO3.
B. Phản ứng giữa H2 và O2 trong không khí.
C. Phản ứng giữa Mg và dung dịch H2SO4 loãng.
D. Phản ứng nhiệt phân thuốc tím.
Câu 28: Phản ứng tỏa nhiệt là
A. phản ứng hấp thụ năng lượng dưới dạng nhiệt.
B. phản ứng giải phóng năng lượng dưới dạng nhiệt.
C. phản ứng không có sự giải phóng năng lượng.
D. phản ứng có ∆rH > 0.
Phần II: Tự luận (3 điểm)
Câu 1 (1,5 điểm): Trong phòng thí nghiệm, khí chlorine có thể được điều chế bằng cách cho MnO2 tác dụng với HCl đặc, đun nóng. Phản ứng hoá học xảy ra theo sơ đồ sau:
MnO2 + HCl MnCl2 + Cl2 + H2O
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá.
b) Giả sử hiệu suất phản ứng đạt 100%. Tính khối lượng MnO2 cần dùng để thu được 2,479 lít khí Cl2 ở điều kiện chuẩn.
Câu 2 (0,5 điểm): Cho phản ứng sau:
Fe2O3 (s) + 3CO (g) 2Fe (s) + 3CO2 (g) = –24,74 kJ
Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
Câu 3 (1 điểm): Cho phản ứng sau: CH≡CH(g) + H2(g) → CH3-CH3(g)
Biết năng lượng liên kết (kJ/ mol) ở điều kiện chuẩn của H-H là 436, của C-C là 347, của C-H là 414 và của C≡C là 839. Hãy cho biết ở điều kiện chuẩn phản ứng thu nhiệt hay tỏa nhiệt?
Hướng dẫn giải đề số 001
Phần I: Trắc nghiệm
|
1 - C |
2 - C |
3 - A |
4 - C |
5 - D |
6 - D |
7 - B |
8 - A |
9 - B |
10 - A |
|
11 - A |
12 - B |
13 - B |
14 - C |
15 - B |
16 - C |
17 - B |
18 - D |
19 - D |
20 - D |
|
21 - A |
22 - C |
23 - A |
24 - A |
25 - A |
26 - D |
27 - C |
28 - B |
|
|
Câu 9:
Tổng hệ số cân bằng (tối giản) của phản ứng là: 2 + 3 + 3 + 1 + 3 = 12.
Câu 12:
Cu + 2H2SO4 (đặc) CuSO4 + SO2 + 2H2O
Theo PTHH có:
Vậy V = 0,1 × 24,79 = 2,479 (lít).
Câu 14:
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Vậy tỉ lệ a : b = 2 : 6 = 1 : 3.
Câu 15:
Phản ứng toả nhiệt: (b) và (d).
Câu 21:
CaCO3(s) → CaO(g) + CO2(g)
= (CaO) + (CO2) - (CaCO3)
= (-635) + (-393,5) – (-1207) = +178,5 (kJ).
Câu 22.
Phát biểu đúng là: (a), (b), (d).
Câu 24:
Phương trình hóa học: Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Biến thiên enthalpy chuẩn của phản ứng:
![]()
Theo phương trình hóa học ta có CO hết, Fe2O3 dư, tính toán theo mol CO.
Từ 1 mol Fe2O3 và 1 mol CO, giả sử chỉ xảy ra phản ứng (1) với hiệu suất 100% thì giải phóng một lượng nhiệt là
Câu 26:
Biến thiên enthalpy chuẩn của phản ứng là:
Phần II: Tự luận
Câu 1:
a)
Chất khử: HCl; chất oxi hoá: MnO2.
Ta có các quá trình:
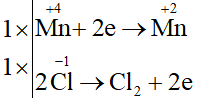
Phương trình hoá học:
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
b) Theo phương trình hoá học ta có:
Khối lượng MnO2 cần dùng là: 0,1.87 = 8,7 (gam).
Câu 2:
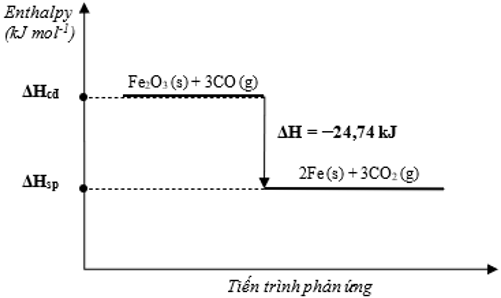
Câu 3:
= 2E(C-H) + E(C≡C) + 2E(H-H) – 6E(C-H) – E(C-C)
= (2.414) + 839 + (2.436) – (6.414) – 347 = -292 (kJ/mol) < 0
⇒ Phản ứng tỏa nhiệt.
Đề thi giữa học kì 2 Hóa học lớp 10 Chân trời sáng tạo có đáp án năm 2023 - Đề 2
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa Học kì 2
Năm học 2022 - 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
|
Sở GD- ĐT … TRƯỜNG THPT …
Mã đề thi: 002
|
ĐỀ KIỂM TRA GIỮA HỌC KÌ II Năm học 2022 - 2023 Môn: Hóa học 10 Bộ: Chân trời sáng tạo Thời gian làm bài: 45 phút; (28 câu trắc nghiệm – 3 câu tự luận) |
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:..................................................................... Lớp: .............................
Đề bài:
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Phát biểu nào sau đây không đúng?
A. Trong một phân tử, tổng số oxi hoá của các nguyên tử bằng 0.
B. Trong hợp chất, oxygen có số oxi hóa bằng -2, trừ một số trường hợp ngoại lệ.
C. Số oxi hóa của hydrogen trong các hydride kim loại bằng +1.
D. Các nguyên tố phi kim có số oxi hóa thay đổi tùy thuộc vào hợp chất chứa chúng.
Câu 2: Số oxi hoá của chlorine trong hợp chất HClO là
A. +1. B. -1.
C. +3. D. +2.
Câu 3: Số oxi hoá của sulfur trong hợp chất là
A. +2. B. +4.
C. +6. D. -2.
Câu 4: Chất nào sau đây có tính khử mạnh?
A. KMnO4. B. F2.
C. H2S. D. CrO3.
Câu 5: Cho các hợp chất sau: NH3; NH4Cl; NaNO3; HNO3; N2O5. Số hợp chất trong đó nitrogen có số oxi hoá -3 là
A. 1. B. 2.
C. 3. D. 4.
Câu 6: Cho các phản ứng hóa học sau:
(a)
(b)
(c)
(d)
Số phản ứng oxi hóa – khử là
A. 4. B. 2.
C. 3. D. 1.
Câu 7: Phản ứng oxi hóa – khử là phản ứng có sự chuyển dịch
A. electron giữa các chất.
B. neutron giữa các chất.
C. proton của nguyên tử.
D. cation.
Câu 8: Cho phản ứng: SO2 + Br2 + 2H2O → 2HBr + H2SO4. Trong phản ứng trên, vai trò của SO2 là
A. chất khử.
B. chất oxi hóa.
C. vừa là chất oxi hóa, vừa là chất tạo môi trường.
D. vừa là chất khử, vừa là chất tạo môi trường.
Câu 9: Trong phản ứng nào sau đây HCl đóng vai trò là chất oxi hoá?
A. 8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O.
B. 2HCl + Na2CO3 → 2NaCl + CO2 + H2O.
C. 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
D. 2HCl + Fe → FeCl2 + H2.
Câu 10: Cho 4,2 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HNO3, thể tích khí NO (đkc) bay ra là (coi NO là sản phẩm khử duy nhất)
A. 1,8593 lít.
B. 3,3600 lít.
C. 3,7185 lít .
D. 5,6360 lít.
Câu 11: Cho phản ứng hoá học sau: Al + HNO3 → Al(NO3)3 + NO + H2O. Hệ số cân bằng (là số nguyên, tối giản) của các chất trong sản phẩm lần lượt là
A. 1, 1, 2.
B. 8, 3, 9.
C. 2, 2, 5.
D. 2, 1, 4.
Câu 12: Trong phản ứng: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O. Số phân tử nitric acid (HNO3) đóng vai trò chất oxi hóa là
A. 8. B. 6.
C. 4. D. 2.
Câu 13: Trên thế giới, zinc (kẽm) được sản xuất chủ yếu từ quặng zinc blende có thành phần chính là ZnS. Ở giai đoạn đầu của quá trình sản xuất, quặng zinc blende được nung trong không khí để thực hiện phản ứng:
ZnS + O2 ZnO + SO2
Tổng hệ số cân bằng (là các số nguyên, tối giản) của chất tham gia trong phản ứng là
A. 4. B. 5.
C. 6. D. 7.
Câu 14: Dẫn khí SO2 vào 10 mL dung dịch KMnO4 0,02M đến khi dung dịch vừa mất màu tím. Phản ứng xảy ra theo sơ đồ sau:
SO2 + KMnO4 + H2O H2SO4 + K2SO4 + MnSO4
Thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn là
A. 12,395 lít.
B. 12,395 mL.
C. 123,95 mL.
D. 123,95 lít.
Câu 15: Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất, kí hiệu là
A. B.
C. D.
Câu 16: Phát biểu nào sau đây không đúng?
A. Các phản ứng cháy thường là phản ứng tỏa nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Câu 17: Cho phản ứng sau:
C(s) + O2(g) → CO2(g)
Nhiệt tạo thành chuẩn của CO2(g) là
A. 393,5 kJ/ mol.
B. – 393,5 kJ/ mol.
C. 39,35 kJ/ mol.
D. – 39,35 kJ/ mol.
Câu 18: Cho các phản ứng sau:
(1) H2(g) + Cl2(g) ® 2HCl (g)
(2) CH4(g) + H2O(l) → CO(g) + 3H2(g)
Phát biểu đúng là
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. Phản ứng (2) thu nhiệt, phản ứng (1) toả nhiệt.
Câu 19: Cho các phát biểu sau:
(a). Trong phòng thí nghiệm, có thể nhận biết một phản ứng thu nhiệt hoặc toả nhiệt bằng cách đo nhiệt độ của phản ứng bằng một nhiệt kế.
(b). Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng thu nhiệt.
(c). Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng toả nhiệt.
(d). Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng toả nhiệt.
(e). Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng thu nhiệt.
Số phát biểu không đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 20: Biết rằng ở điều kiện chuẩn, 1 mol ethanol cháy tỏa ra một nhiệt lượng là 1,37 × 103 kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng được được giải phóng ra dưới dạng nhiệt bởi phản ứng là
A. 0,450 kJ.
B. 2,25 × 103 kJ.
C. 4,50 × 102 kJ.
D. 1,37 × 103 kJ.
Câu 21: Phương trình nhiệt học của phản ứng nhiệt phân hoàn toàn 1 mol Cu(OH)2 ở điều kiện chuẩn, tạo thành 1 mol CuO và 1 mol H2O, thu vào nhiệt lượng 9,0 kJ là
A. Cu(OH)2(s) CuO(s) + H2O(l); = –9,0 kJ.
B. Cu(OH)2(s) CuO(s) + H2O(l); = +9,0 kJ.
C. CuO(s) + H2O(l) Cu(OH)2(s); = –9,0 kJ.
D. CuO(s) + H2O(l) Cu(OH)2(s); = +9,0 kJ.
Câu 22: Cho phản ứng sau:
SO2(g) + O2(g) ® SO3(l)
Biến thiên enthalpy chuẩn của phản ứng tính theo nhiệt tạo thành là
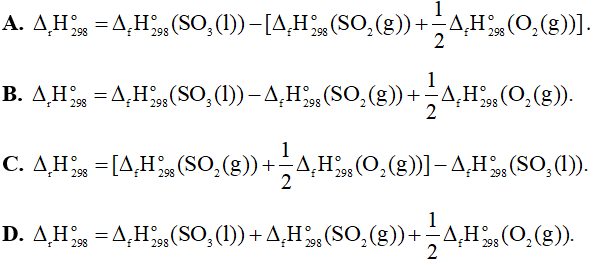
Câu 23: Xác định biến thiên enthalpy chuẩn của phản ứng:
C2H2(g) + 2H2(g) ® C2H6(g)
Biết năng lượng liên kết (ở điều kiện chuẩn): Eb (H–H) = 436 kJ/mol; Eb (C–H) = 418 kJ/mol; Eb (CºC) = 837 kJ/mol.
A. +309 kJ.
B. –309 kJ.
C. –358 kJ.
D. +358 kJ.
Câu 24: Phát biểu nào sau đây không đúng?
A. Để so sánh biến thiên enthalpy của các phản ứng khác nhau thì cần xác định chúng ở cùng một điều kiện.
B. Phản ứng hóa học là quá trình phá vỡ các liên kết trong chất đầu và hình thành các liên kết mới để tạo thành sản phẩm.
C. Sự phá vỡ liên kết giải phóng năng lượng, trong khi sự hình thành liên kết lại cần cung cấp năng lượng.
D. Khi than, củi cháy, không khí xung quanh ấm hơn do phản ứng tỏa nhiệt.
Câu 25: Cho các phản ứng sau:
(1) Phản ứng tôi vôi: CaO + H2O → Ca(OH)2.
(2) Phản ứng trung hoà acid – base: HCl + NaOH → NaCl + H2O.
(3) Phản ứng nhiệt phân potassium chlorate: 2KClO3 2KCl + 3O2.
Phản ứng toả nhiệt là
A. (1). B. (2).
C. (3). D. (1), (2).
Câu 26: Cho phản ứng sau:
CO(g) + O2(g) ® CO2(g)
Biến thiên enthalpy của phản ứng ở điều kiện chuẩn là
(Biết nhiệt tạo thành chuẩn của CO2(g) là –393,5 kJ/mol, của CO(g) là –110,5 kJ/mol).
A. –283 kJ.
B. +283 kJ.
C. –316 kJ.
D. +316 kJ.
Câu 27: Khẳng định sai là
A. Nếu biến thiên enthalpy có giá trị âm thì phản ứng tỏa nhiệt.
B. Nếu biến thiên enthalpy có giá trị dương thì phản ứng thu nhiệt.
C. Biến thiên enthalpy càng âm thì phản ứng tỏa nhiệt càng ít.
D. Biến thiên enthalpy càng dương thì phản ứng thu nhiệt càng nhiều.
Câu 28: Biến thiên enthalpy chuẩn của một phản ứng được mô tả ở sơ đồ dưới đây:
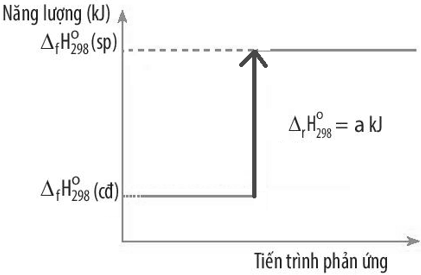
Kết luận nào sau đây đúng?
A. Phản ứng tỏa nhiệt.
B. Năng lượng chất tham gia phản ứng lớn hơn năng lượng sản phẩm.
C. Biến thiên enthalpy của phản ứng là -a kJ/mol.
D. Phản ứng thu nhiệt.
Phần II: Tự luận
Câu 1 (1 điểm): Lập các phương trình hoá học sau theo phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
a) CaO + C CaC2 + CO.
b) .
Câu 2 (1 điểm): Cho phản ứng sau:
C(graphite) + O2(g) CO2(g)
a) Cho biết ý nghĩa của giá trị
b) Hợp chất CO2(g) bền hơn hay kém bền hơn về mặt năng lượng so với các đơn chất bền C(graphite) và O2(g).
Câu 3 (1 điểm): Phosgene (COCl2) là một hợp chất hữu cơ, nó còn được gọi với tên là chất độc quang khí. Phosgene được điều chế bằng cách cho hỗn hợp CO và Cl2 đi qua than hoạt tính.
Biết ở điều kiện chuẩn: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl) = 339 kJ/mol; Eb(C=O) = 745 kJ/mol; Eb(C≡O) = 1075 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng tạo thành phosgene từ CO và Cl2.
Hướng dẫn giải đề số 002
Phần I: Trắc nghiệm
|
1 - C |
2 - A |
3 - B |
4 - C |
5 - B |
6 - D |
7 - A |
8 - A |
9 - D |
10 - A |
|
11 - A |
12 - D |
13 - B |
14 - B |
15 - C |
16 - D |
17 - B |
18 - C |
19 - B |
20 - C |
|
21 - B |
22 - A |
23 - B |
24 - C |
25 - D |
26 - A |
27 - C |
28 - D |
|
|
Câu 10:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Theo phương trình hoá học:
Vậy VNO = 0,075.24,79 = 1,8593 (lít).
Câu 11:
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Câu 12:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Þ Cứ 4 phân tử HNO3 tham gia phản ứng thì có 2 phân tử đóng vai trò là chất oxi hoá, 2 phân tử đóng vai trò là môi trường trong dung dịch.
Câu 13:
Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron:
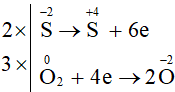
2ZnS + 3O2 2ZnO + 2SO2
Tổng hệ số của chất tham gia là: 2 + 3 = 5.
Câu 14:
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + K2SO4 + 2MnSO4
Theo phương trình hóa học ta có:
= 24,79.0,0005 = 0,012395 L = 12,395 (mL).
Câu 19:
Phát biểu (b) và (d) không đúng.
Câu 20:
Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng được được giải phóng ra dưới dạng nhiệt bởi phản ứng là
Câu 23:
Phương trình hóa học:
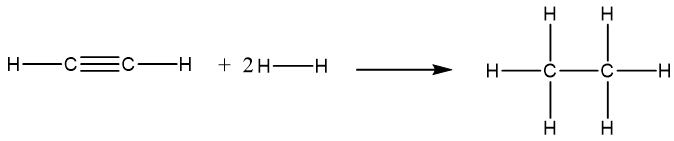
Vậy = Eb (CºC) + 2Eb (C–H) + 2Eb (H–H) – Eb (C–C) – 6Eb (C–H)
= 837 + 2×418 + 2×436 – 346 – 6×418 = –309 (kJ).
Câu 26:
= –393,5 – (–110,5 + 0×) = –283 (kJ).
Phần II: Tự luận
Câu 1:
a)
Trong phản ứng C vừa đóng vai trò là chất oxi hoá, vừa đóng vai trò là chất khử.
Ta có các quá trình:
Quá trình oxi hóa:
Quá trình khử:
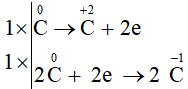
Phương trình hoá học:
CaO + 3C CaC2 + CO
![]()
- Chất khử: C12H22O11; chất oxi hóa: H2SO4.
Ta có các quá trình:
Quá trình oxi hoá:
![]()
Quá trình khử:
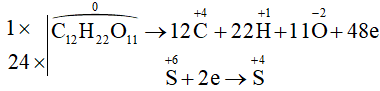
Phương trình hóa học:
![]()
Câu 2:
a) = -393,50kJ/mollà lượng nhiệt toả ra khi tạo thành 1 mol CO2 (g) từ các đơn chất ở trạng thái bền nhất ở điều kiện chuẩn.
b) = -393,50 kJ/mol⇒ Hợp chất CO2(g) bền hơn về mặt năng lượng so với các đơn chất bền C(graphite) và O2(g).
Câu 3:
Áp dụng công thức:
= EC≡O + ECl – Cl – EC=O – 2EC – Cl
= 1075 + 243 – 745 – 2.339 = - 105 kJ.
Đề thi giữa học kì 2 Hóa học lớp 10 Chân trời sáng tạo có đáp án năm 2023 - Đề 3
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa Học kì 2
Năm học 2022 - 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
|
Sở GD- ĐT … TRƯỜNG THPT …
Mã đề thi: 001
|
ĐỀ KIỂM TRA GIỮA HỌC KÌ II Năm học 2022 - 2023 Môn: Hóa học 10 Bộ: Chân trời sáng tạo Thời gian làm bài: 45 phút; (28 câu trắc nghiệm – 3 câu tự luận) |
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:..................................................................... Lớp: .............................
Đề bài:
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nhận xét nào sau đây về số oxi hoá là không đúng?
A. Số oxi hoá là đại lượng quan trọng trong việc nghiên cứu các phản ứng có sự dịch chuyển electron.
B. Số oxi hoá được đặt phía trên kí hiệu nguyên tố.
C. Số oxi hoá của hydrogen trong tất cả các hợp chất là +1.
D. Số oxi hoá của nguyên tử trong các đơn chất bằng 0.
Câu 2: Số oxi hoá của phosphorus trong hợp chất P2O3 là
A. + 1. B. +3.
C. +5. D. +7.
Câu 3: Số oxi hoá của sulfur trong hợp chất Na2S2O3 là
A. +2. B. +4.
C. +6. D. -2.
Câu 4: Trong trường hợp nào sau đây nitrogen có số oxi hoá là -3?
A. N2. B. N2O.
C. N2O3. D. NH4+.
Câu 5: Cho các hợp chất sau: H2S; SO2; SO3; H2SO4; Na2SO4. Số hợp chất trong đó S có số oxi hoá +4 là
A. 1. B. 2.
C. 3. D. 4.
Câu 6: Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A. Số proton.
B. Số oxi hóa.
C. Số khối.
D. Số hiệu nguyên tử.
Câu 7: Cho phản ứng: 2NH3 + 3Cl2 → N2 + 6HCl. Trong đó, Cl2 đóng vai trò là
A. chất khử.
B. vừa là chất oxi hoá vừa là chất khử.
C. chất oxi hoá.
D. không phải là chất khử, không là chất oxi hoá.
Câu 8: Cho các phản ứng hoá học sau, phản ứng oxi hoá – khử là
A. FeO + 2HCl → FeCl2 + H2O.
B. Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O.
C. FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O.
D. FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl.
Câu 9: Chất khử là chất
A. nhường electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
B. nhường electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 10: Chất nào sau đây có tính oxi hoá mạnh?
A. H2S. B. KI.
C. KMnO4. D. NH3.
Câu 11: Cho phương trình phản ứng: aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O.
Tỉ lệ a : b là
A. 1 : 3.
B. 2 : 3.
C. 2 : 5.
D. 1 : 4.
Câu 12: Trong phản ứng MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O. Số phân tử HCl đóng vai trò là chất khử là
A. 1. B. 2.
C. 3. D. 4.
Câu 13: Cho vào ống nghiệm 2 – 3 ml dung dịch H2SO4 1M, sau đó thả vài mẩu kẽm hạt vào. Kẽm phản ứng với H2SO4 theo phương trình hoá học:
Zn + H2SO4 → ZnSO4 + H2
Nhận xét nào sau đây là sai?
A. Zn nhường electron nên là chất khử.
B. Quá trình H+ nhận electron là quá trình khử.
C. Quá trình H+ nhận electron là quá trình oxi hoá.
D. Ion H+ đã nhận electron nên H+ là chất oxi hoá.
Câu 14: Hàm lượng iron (II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate theo sơ đồ sau:
FeSO4 + KMnO4 + H2SO4 - - - → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Thể tích KMnO4 0,02M để phản ứng vừa đủ với 10 mL dung dịch FeSO4 0,1M là
A. 10 mL. B. 15 mL.
C. 20 mL. D. 25 mL.
Câu 15: Phản ứng toả nhiệt là
A. phản ứng hoá học trong đó có sự giải phóng nhiệt năng ra môi trường.
B. phản ứng hoá học trong đó có sự hấp thụ nhiệt năng từ môi trường.
C. phản ứng làm nhiệt độ môi trường xung quanh lạnh đi.
D. phản ứng không làm thay đổi nhiệt độ môi trường xung quanh.
Câu 16: Cho các quá trình hoá học sau:
(a) Nhiệt phân Cu(OH)2 tạo thành CuO.
(b) Đốt cháy than trong không khí.
(c) Nhiệt phân potassium chlorate.
(d) Hoà tan viên vitamin C sủi vào cốc nước.
Số quá trình thu nhiệt là
A. 1. B. 2.
C. 3. D. 4.
Câu 17: Cho hai phương trình nhiệt hoá học sau:
(1) C(s) + H2O(g) CO(g) + H2(g)
(2) CuSO4(aq) + Zn(s) → ZnSO4(aq) + Cu(s)
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
Câu 18: Cho các phát biểu sau:
(a) Enthalpy tạo thành được kí hiệu là DfH.
(b) Enthalpy tạo thành chuẩn của đơn chất bền nhất bằng 0.
(c) Enthalpy tạo thành có đơn vị là kJ/ mol hoặc kcal/ mol.
(d) Enthalpy tạo thành chuẩn được kí hiệu là
Số phát biểu đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 19: Cho phương trình nhiệt hóa học sau:
H2(g) + I2(g) → 2HI(g)
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là đúng?
A. Phản ứng toả nhiệt.
B. Phản ứng giải phóng nhiệt lượng 11,3 kJ khi 2 mol HI được tạo thành.
C. Tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm.
D. Năng lượng chứa trong H2 và I2 cao hơn trong HI.
Câu 20: Biến thiên enthalpy của một phản ứng được thể hiện theo sơ đồ sau:
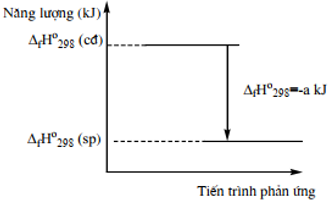
Phát biểu đúng là
A. Biến thiên enthalpy của phản ứng là a kJ/ mol.
B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm.
C. Phản ứng thu vào a kJ nhiệt lượng.
D. Phản ứng toả nhiệt.
Câu 21: Số lượng mỗi loại liên kết có trong phân tử CH3Cl là
A. 1 liên kết H – Cl; 1 liên kết H – H; 1 liên kết C – H.
B. 1 liên kết C – Cl; 1 liên kết H – H; 1 liên kết C – H.
C. 3 liên kết C – H; 1 liên kết C – Cl.
D. 3 liên kết C – H; 1 liên kết H – Cl.
Câu 22: Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO(g) + O2(g) → CO2(g)
Biết nhiệt tạo thành chuẩn của CO2: (CO2(g)) = –393,5 kJ/mol. Nhiệt tạo thành chuẩn của CO là
A. –110,5 kJ. B. +110,5 kJ.
C. –141,5 kJ. D. –221,0 kJ.
Câu 23: Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) → 2NO(g) = +180 kJ
Kết luận nào sau đây đúng?
A. Phản ứng xảy ra thuận lợi ở điều kiện thường.
B. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
C. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
D. Phản ứng toả ra 180 kJ nhiệt lượng.
Câu 24: Cho phương trình nhiệt hóa học sau:
Enthalpy tạo thành chuẩn của NH3 là
A. – 91,8 kJ/ mol.
B. + 91,8 kJ/ mol.
C. – 45,9 kJ/ mol.
D. + 45,9 kJ/ mol.
Câu 25: Cho các phản ứng sau:
(b)
(c) CH4(g) + H2O(l) → CO(g) + 3H2(g)
(d) H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l)
Số phản ứng thu nhiệt là
A. 4. B. 3.
C. 2. D. 1.
Câu 26: Cho phản ứng tổng quát: aA + bB → mM + nN. Hãy chọn phương án tính đúng của phản ứng:
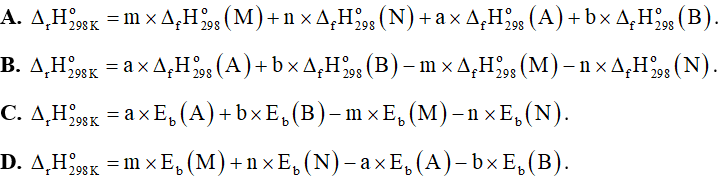
Câu 27: Cho phản ứng hydrogen hóa ethylene sau:
H2C=CH2(g) + H2(g) → H3C-CH3(g)
Biết năng lượng trung bình các liên kết trong các chất cho trong bảng sau:
|
Liên kết |
Eb (kJ/mol) |
Liên kết |
Eb (kJ/mol) |
|
C=C |
612 |
C-C |
346 |
|
C-H |
418 |
H-H |
436 |
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
A. 478. B. 284.
C. 134. D. -134.
Câu 28: Đốt cháy hoàn toàn 1 gam C2H2 (g) ở điều kiện chuẩn, thu được CO2 (g) và H2O (l), giải phóng 50,01 kJ. Biến thiên enthalpy chuẩn của phản ứng đốt cháy 1 mol C2H2 (g) là
A. = − 50,01 kJ.
B. = 50,01 kJ.
C. = − 1300,26 kJ.
D. = 1300,26 kJ.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Hoà tan Al kim loại vào dung dịch HNO3 loãng thu được dung dịch chứa 2 muối Al(NO3)3 và NH4NO3 (không có khí thoát ra).
a) Viết phương trình hoá học xảy ra.
b) Tính khối lượng muối có trong dung dịch thu được khi hoà tan hoàn toàn 0,27 gam nhôm.
Câu 2 (1 điểm): Phản ứng tôi vôi xảy ra như sau:
CaO(s) + H2O(l) → Ca(OH)2(aq)
Cho biết enthalpy tạo thành chuẩn như sau:
|
Hợp chất |
CaO(s) |
H2O(l) |
Ca(OH)2(aq) |
|
(kJ/ mol) |
- 635,6 |
-285,8 |
-986,6 |
Tính lượng nhiệt giải phóng khi cho 0,1kg CaO(s) vào chiếc bình vôi có chứa lượng nước dư.
Câu 3 (1 điểm): Quá trình đốt cháy ethanol diễn ra theo sơ đồ phản ứng:
C2H5OH (l) + O2 (g) CO2 (g) + H2O (l)
a) Cân bằng phản ứng trên theo phương pháp thăng bằng electron, chỉ rõ chất oxi hoá, chất khử.
b) Tính của phản ứng trên từ các giá trị năng lượng liên kết sau:
EC–C = 347 kJ/ mol; EO=O = 496 kJ/ mol; EC–O = 336 kJ/ mol; EC–H = 410 kJ/ mol; EC=O = 805 kJ/ mol; EO–H = 465 kJ/ mol.
Đề thi giữa học kì 2 Hóa học lớp 10 Chân trời sáng tạo có đáp án năm 2023 - Đề 4
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa Học kì 2
Năm học 2022 - 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
Sở GD- ĐT … TRƯỜNG THPT …
Mã đề thi: 002
|
ĐỀ KIỂM TRA GIỮA HỌC KÌ II Năm học 2022 - 2023 Môn: Hóa học 10 Bộ: Chân trời sáng tạo Thời gian làm bài: 45 phút; (28 câu trắc nghiệm – 3 câu tự luận) |
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:..................................................................... Lớp: .............................
Đề bài:
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Quy tắc xác định số oxi hoá nào sau đây là sai?
A. Số oxi hoá của nguyên tử trong các đơn chất bằng 0.
B. Trong một phân tử, tổng số oxi hoá của các nguyên tử bằng 0.
C. Số oxi hoá của nguyên tử trong ion đơn nguyên tử bằng điện tích của ion.
D. Trong các hợp chất, kim loại kiềm thổ có số oxi hoá là +1.
Câu 2: Số oxi hoá của nitrogen trong hợp chất NH3 là
A. +3. B. -3.
C. +1. D. -1.
Câu 3: Số oxi hoá của Mn trong ion MnO4- là
A. +6. B. +7.
C. +8. D. +2.
Câu 4: Trong trường hợp nào sau đây, sulfur có số oxi hoá là +6?
A. H2S. B. SO2.
C. D. K2SO4.
Câu 5: Cho các hợp chất sau: CO; CO2; CH4; Na2CO3. Số hợp chất trong đó C có số oxi hoá +4 là
A. 1. B. 2.
C. 3. D. 4.
Câu 6: Cho phản ứng: Cl2 + 2NaOH → NaCl + NaClO + H2O. Trong đó, Cl2 đóng vai trò
A. chất khử.
B. vừa là chất oxi hoá vừa là chất khử.
C. chất oxi hoá.
D. không phải là chất khử, không là chất oxi hoá.
Câu 7: Phát biểu nào dưới đây không đúng?
A. Phản ứng oxi hoá - khử là phản ứng luôn xảy ra đồng thời sự oxi hoá và sự khử.
B. Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của một số nguyên tố.
C. Phản ứng oxi hoá - khử là phản ứng có sự thay đổi số oxi hoá của tất cả các nguyên tố.
D. Phản ứng oxi hoá - khử là phản ứng có sự chuyển electron giữa các chất phản ứng.
Câu 8: Chất oxi hoá là chất
A. nhường electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
B. nhường electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 9: Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
A. sự khử Fe2+ và sự oxi hóa Cu.
B. sự khử Fe2+ và sự khử Cu2+.
C. sự oxi hóa Fe và sự oxi hóa Cu.
D. sự oxi hóa Fe và sự khử Cu2+.
Câu 10: Ở điều kiện thích hợp xảy ra các phản ứng sau:
(a) 2C + Ca → CaC2.
(b) C + 2H2 → CH4.
(c) C + CO2 → 2CO.
(d) 3C + 4Al → Al4C3.
Trong các phản ứng trên, tính khử của cacbon thể hiện ở phản ứng
A. (c). B. (b).
C. (a). D. (d).
Câu 11: Cho phản ứng hoá học sau: Al + HNO3 → Al(NO3)3 + NO + H2O. Hệ số cân bằng (là số nguyên, tối giản) của các chất trong sản phẩm lần lượt là
A. 8, 3, 15. B. 8, 3, 9.
C. 2, 2, 5. D. 2, 1, 4.
Câu 12: Sulfur trong hợp chất nào sau đây vừa có tính oxi hoá, vừa có tính khử?
A. Na2SO4. B. SO2.
C. H2S. D. H2SO4.
Câu 13: Cho kim loại Zn phản ứng với dung dịch CuSO4. Kim loại Zn phản ứng với CuSO4 theo phương trình hoá học:
Zn + CuSO4 → ZnSO4 + Cu
Nhận xét nào sau đây là đúng?
A. Zn là chất oxi hoá.
B. CuSO4 là chất khử.
C. Quá trình oxi hoá:
D. Quá trình khử:
Câu 14: Sục khí SO2 vào dung dịch KMnO4 (thuốc tím), màu tím nhạt dần rồi mất màu (biết sản phẩm tạo thành là MnSO4, H2SO4 và H2O). Nguyên nhân là do
A. SO2 đã oxi hóa KMnO4 thành MnO2.
B. SO2 đã khử KMnO4 thành Mn2+.
C. KMnO4 đã khử SO2 thành .
D. H2O đã oxi hóa KMnO4 thành Mn2+.
Câu 15: Phản ứng thu nhiệt là
A. phản ứng làm nhiệt độ môi trường xung quanh nóng lên.
B. phản ứng hoá học trong đó có sự giải phóng nhiệt năng ra môi trường.
C. phản ứng hoá học trong đó có sự hấp thụ nhiệt năng từ môi trường.
D. phản ứng đốt cháy nhiên liệu.
Câu 16: Cho các phản ứng sau:
(a) Phản ứng nhiệt nhôm.
(b) Phản ứng trung hoà (acid tác dụng với base).
(c) Phản ứng quang hợp.
(d) Phản ứng đốt cháy nhiên liệu.
Số phản ứng toả nhiệt là
A. 1. B. 2.
C. 3. D. 4.
Câu 17: Khẳng định nào sau đây là đúng?
A. Enthalpy tạo thành chuẩn của các đơn chất đều bằng 0.
B. Enthalpy tạo thành chuẩn của các hợp chất đều bằng 0.
C. Enthalpy tạo thành chuẩn của các đơn chất bền nhất đều bằng 0.
D. Cả A, B và C đều sai.
Câu 18: Cho hai phương trình nhiệt hoá học sau:
(1) H2(g) + F2(g) → 2HF(g)
(2) H2(g) + I2(g) → 2HI(g)
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều thu nhiệt.
B. Phản ứng (2) diễn ra thuận lợi hơn phản ứng (1).
C. Cả hai phản ứng đều toả nhiệt.
D. Phản ứng (1) diễn ra thuận lợi hơn phản ứng (2).
Câu 19: Cho phản ứng nhiệt phân CaCO3 như sau:
CaCO3(s) CaO(s) + CO2(g)
Phát biểu nào sau đây là đúng?
A. Phản ứng toả nhiệt.
B. Nhiệt lượng toả ra của phản ứng là 178,49 kJ.
C. Phản ứng cần cung cấp nhiệt liên tục.
D. Phản ứng xảy ra thuận lợi ở điều kiện thường.
Câu 20: Điều kiện chuẩn là điều kiện ứng với
A. áp suất 1 bar (đối với chất khí).
B. nồng độ 1 mol/ L (đối với chất tan trong dung dịch).
C. nhiệt độ thường được chọn là 298 K (25° C).
D. Cả A, B và C đúng.
Câu 21: Cho phản ứng nhiệt học sau:
2Na (s) + O2 (g) ⟶ Na2O (s) = − 418,0 kJ.
Nếu chỉ có 0,4 mol Na(s) tham gia phản ứng ở điều kiện chuẩn thì lượng nhiệt tỏa ra là
A. 418 kJ.
B. 209 kJ.
C. 836 kJ.
D. 83,6 kJ.
Câu 22: Cho phản ứng nhiệt học sau:
H2(g) + Cl2(g) ⟶ 2HCl(g)
Nhiệt tạo thành chuẩn của HCl(g) là
A. – 184,6 kJ/ mol.
B. + 184,6 kJ/ mol.
C. – 92,3 kJ/ mol.
D. + 92,3 kJ/ mol.
Câu 23: Cho phản ứng tổng hợp ammonia (NH3) như sau:
N2(g) + 3H2(g) → 2NH3(g)
Biết năng lượng liên kết (kJ/mol) của N≡N và H–H lần lượt là 946 và 436. Năng lượng liên kết của N–H trong ammonia là
A. 391 kJ/mol.
B. 361 kJ/mol.
C. 245 kJ/mol.
D. 490 kJ/mol.
Câu 24: Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P) xảy ra như sau: P (s, đỏ) ⟶ P (s, trắng) = 17,6 kJ
Điều này chứng tỏ phản ứng:
A. thu nhiệt, P đỏ bền hơn P trắng.
B. thu nhiệt, P trắng bền hơn P đỏ.
C. toả nhiệt, P đỏ bền hơn P trắng.
D. toả nhiệt, P trắng bền hơn P đỏ.
Câu 25: Cho phản ứng hoá học sau: 2NaCl(s) → 2Na(s) + Cl2(g). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
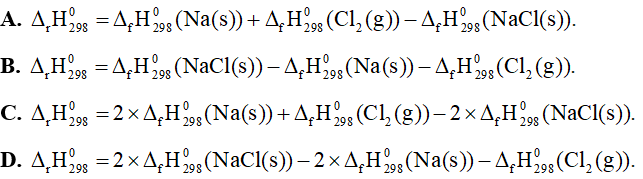
Câu 26: Cho giản đồ sau:
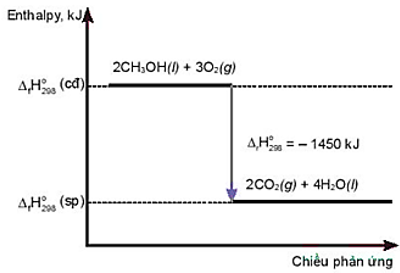
Nhận xét nào sau đây là sai?
A. Phản ứng toả nhiệt.
B. Nhiệt lượng toả ra của phản ứng là 1450 kJ.
C. Phản ứng cần cung cấp nhiệt liên tục.
D. Phản ứng xảy ra thuận lợi ở điều kiện thường.
Câu 27: Cho phản ứng nhiệt nhôm sau: 2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm là
Biết:
|
Chất |
Al (s) |
Fe2O3 (s) |
Fe (s) |
Al2O3 (s) |
|
(kJmol-1) |
0 |
-825,5 |
0 |
-1676,0 |
A. +850,5 kJ.
B. - 850,5 kJ.
C. -839 kJ.
D. +839 kJ.
Câu 28: Cho các phát biểu sau:
(a) Sự phá vỡ các liên kết cần cung cấp năng lượng.
(b) Sự đốt cháy của nhiên liệu luôn sinh nhiệt.
(c) Phản ứng quang hợp là phản ứng thu nhiệt.
(d) Nước lỏng bay hơi là quá trình toả nhiệt.
Số phát biểu đúng là
A. 1. B. 2.
C. 3. D. 4.
Phần II: Tự luận (3 điểm)
Câu 1 (1,5 điểm): Để điều chế khí chlorine trong phòng thí nghiệm người ta tiến hành cho dung dịch HCl đặc tác dụng với tinh thể KMnO4. Phản ứng xảy ra theo sơ đồ sau:
KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O
a) Cân bằng phản ứng trên theo phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Giả sử hiệu suất phản ứng đạt 100%. Tính khối lượng KMnO4 cần dùng để điều chế được 2,479 lít khí Cl2 ở điều kiện chuẩn.
Câu 2 (1 điểm): Muối ammonium bicarbonate (NH4HCO3) được sử dụng làm bột nở, giúp cho bánh nở to, xốp và mềm. Dựa vào phản ứng và các dữ kiện sau hãy lựa chọn cách bảo quản ammonium bicarbonate đúng?
NH4HCO3 (s) NH3 (g) + CO2 (g) + H2O (g)
|
Chất |
NH4HCO3 (s) |
NH3 (g) |
CO2 (g) |
H2O (g) |
|
(kJmol-1) |
–849,40 |
–46,11 |
–393,51 |
–241,82 |
Câu 3 (0,5 điểm): Cho phương trình nhiệt hóa học của phản ứng:
Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng trên
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.