Toptailieu.vn xin giới thiệu 30 câu trắc nghiệm Liên kết ion Chân trời sáng tạo (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
30 câu trắc nghiệm Liên kết ion Chân trời sáng tạo (có đáp án 2023) CHỌN LỌC
Lý thuyết
I) Tổng quát
1) Ion, cation, anion
- Khi số proton mang điện dương bằng số electron mang điện âm nhường hay nhận e để trở thành phần tử mang điện được gọi là ion.
- Với mục đích là để đạt được cấu hình bền của khí hiếm trong phương trình hóa học, những nguyên tử kim loại có khuynh hướng nhường e cho nguyên tử các nguyên tố khác để trở thành phần tử mang điện dương được gọi là Cation.
- Để đạt cấu hình bền của khí hiếm trong phương trình hóa học thì những nguyên tử phi kim có khuynh hướng nhận thêm e của nguyên tử các nguyên tố khác để trở thành phân tử mang điện âm thì được gọi là Anion.
♦ Chú ý: Quy tắc bát tử các nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đát được cấu hình bền vững của khí hiệu với 8 e ( với Heli là 2e) ở lớp ngoài cùng.
2) Thế nào là ion đơn nguyên tử và ion đa nguyên tử.
- Ion được tạo nên từ 1 nguyên tử được gọi là ion đơn nguyên.
- Những nhóm nguyên tử mang điện tích dương (hay âm) tạo nên ion thì được gọi là ion đa nguyên.
II) Khái niệm liên kết ion là gì?
- Hiểu một cách đơn giản thì liên kết mà hình thành bởi những lực hút tĩnh điện giữa các ion mang điện trái dấu (dương âm) gọi là liên kết ion.
- Tính chất:
III) Cách phân biệt liên kết ion và liên kết cộng hóa trị
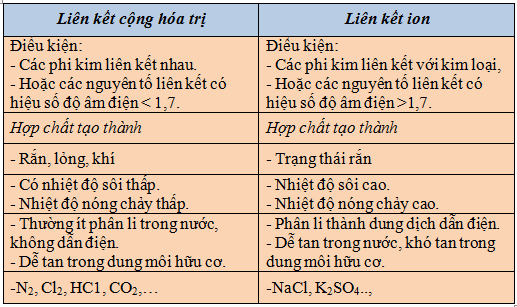
(Bảng phân biệt liên kết ion và liên kết cộng hóa trị)
IV) Tinh thể ion
- Ở đkt, hợp chất ion thường tồn tại ở dạng tinh thể.
- Tính chất:
- Nhờ lực hút tĩnh điện mà các ion liên kết với nhau.
Bài tập
Câu 1: Chỉ ra nội dung sai khi nói về ion:
A. Ion được hình thành khi nguyên tử nhường hay nhận electron.
B. Ion là phần tử mang điện.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
D. Ion âm gọi là cation, ion dương gọi là anion.
Đáp án: D
Giải thích:
Ion âm gọi là anion, ion dương gọi là cation.
Câu 2: Cho các hợp chất sau: BaF2, MgO, HCl, H2O. Hợp chất nào là hợp chất ion?
A. BaF2 và HCl
B. MgO và H2O
C. HCl và H2O
D. BaF2 và MgO
Đáp án: D
Giải thích:
BaF2 và MgO là hợp chất ion.
HCl và H2O là hợp chất cộng hóa trị.
Câu 3: Ion X có cấu hình electron lớp vỏ ngoài cùng là 2s22p6. Ion X là?
A. Cl−
B. Na+ hoặc Cl−
C. Mg2+ hoặc Cl−
D. Na+ hoặc Mg2+
Đáp án: D
Giải thích:
Tổng số electron của ion là 10
→ X có thể là F−, Na+, Mg2+
Câu 4: X là nguyên tố thuộc nhóm A, ion có cấu hình electron là 1s22s22p6. Số nguyên tố hóa học thỏa mãn với điều kiện trên là
A. 3.
B. 4.
C. 5.
D. 2.
Đáp án: A
Giải thích:
Ion Xn+ là cation và X là nguyên tố thuộc nhóm A
→ n = 1 hoặc n = 2 hoặc n = 3.
Ion Xn+ có cấu hình electron là 1s22s22p6.
→ X thuộc chu kì 3.
→ Có 3 nguyên tố hóa học thỏa mãn với số hiệu nguyên tử lần lượt là 11, 12 và 13.
Câu 5: Chọn phát biểu đúng?
A. Hợp chất ion có nhiệt độ nóng chảy thấp
B. Hợp chất ion có nhiệt độ nóng chảy cao.
C. Hợp chất ion dễ hóa lỏng.
D. Hợp chất ion có nhiệt độ sôi không xác định.
Đáp án: B
Giải thích:
Các hợp chất ion đều khá rắn, khó bay hơi, khó nóng chảy và thường tan nhiều trong nước.
→ B đúng.
Câu 6: Liên kết ion là loại liên kết hóa học được hình thành nhờ lực hút tĩnh điện giữa:
A. electron chung và hạt nhân nguyên tử.
B. các anion.
C. cation và electron tự do.
D. cation và anion.
Đáp án: D
Giải thích:
Liên kết ion là loại liên kết hóa học được hình thành nhờ lực hút tĩnh điện giữa cation và anion.
Câu 7: Nguyên tử X nhận n electron để hình thành anion Xn−. Xác định nguyên tử X ? Biết rằng, cấu hình electron lớp vỏ ngoài cùng của anion là 3s23p6.
A. Clo
B. Kali
C. Oxi
D. Flo
Đáp án: A
Giải thích:
Nguyên tử X nhận n electron để hình thành anion Xn−
→ X là phi kim.
Cấu hình electron lớp vỏ ngoài cùng của anion là 3s23p6
→ X thuộc chu kì 3.
→ Clo thỏa mãn.
Câu 8: Dãy chỉ chứa các hợp chất có liên kết ion là:
A. SO3, H2S, H2O
B. SO2, CO2, Na2O
C. BaCl2, NaCl, MgO
D. CaCl2, Cl2, HCl
Đáp án: C
Giải thích:
A. Đều là hợp chất cộng hóa trị.
B. SO2 và CO2 là hợp chất cộng hóa trị.
C. Thỏa mãn.
D. Cl2 và HCl là hợp chất cộng hóa trị.
Câu 9: Trong mạng tinh thể ion, liên kết giữa các nút mạng đó là?
A. Liên kết cho nhận.
B. Liên kết cộng hóa trị bền.
C. Liên kết Van Der van.
D. Liên kết ion.
Đáp án: D
Giải thích:
Trong tinh thể ion, các ion phân bố luân phiên trên các đỉnh → liên kết giữa các nút mạng là liên kết ion hình thành do lực hút tĩnh điện giữa các ion trái dấu.
Câu 10: Trong tinh thể NaCl, nguyên tử Na và Cl ở dạng ion. Số electron lần lượt của hai ion trên là
A. 10 và 10
B. 12 và 16
C. 10 và 18
D. 11 và 17
Đáp án: C
Giải thích:
2Na + Cl2 → 2Na + Cl−
→ Nguyên tử 11Na nhường 1 electron
→ Ion Na+ có 10 electron.
Nguyên tử 17Cl nhận 1 electron
→ Ion Cl− có 18 electron.
Câu 11: Hợp chất nào sau đây chứa ion đa nguyên tử?
A. HBr.
B. K2O.
C. NH4HCO3.
D. Na2S.
Đáp án: C
Giải thích:
Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hoặc âm.
Câu 12: Nhận định nào sau đây là sai?
A. Tinh thể ion rất bền vững.
B. Các hợp chất ion đều khá rắn, khó bay hơi, khó nóng chảy.
C. Các hợp chất ion thường tan nhiều trong nước.
D. Các hợp chất ion khi nóng chảy đều không dẫn điện.
Đáp án: D
Giải thích:
D sai vì khi nóng chảy các hợp chất ion thì chúng dẫn được điện.
Câu 13: Hầu hết các hợp chất ion:
A. có nhiệt độ nóng chảy và nhiệt độ sôi cao.
B. dễ hòa tan trong các dung môi hữu cơ.
C. ở trạng thái nóng chảy không dẫn điện.
D. tan trong nước thành dung dịch không điện li.
Đáp án: A
Giải thích:
Hầu hết các hợp chất ion khó nóng chảy, khó bay hơi
→ Nhiệt độ nóng chảy và nhiệt độ sôi cao.
Câu 14: Bản chất của liên kết ion là lực hút tĩnh điện giữa
A. 2 ion.
B. các ion mang điện trái dấu.
C. các hạt mang điện trái dấu.
D. hạt nhân và các electron hóa trị.
Đáp án: B
Giải thích:
Bản chất của liên kết ion là lực hút tĩnh điện giữa các ion mang điện trái dấu.
Câu 15: Chất nào sau đây ở trạng thái rắn tồn tại dưới dạng tinh thể ion?
A. Than chì.
B. Kim cương.
C. Nước đá.
D. Muối ăn.
Đáp án: D
Giải thích:
Muối ăn ở trạng thái rắn tồn tại dưới dạng tinh thể ion.
Câu 16: Nguyên tử trung hòa về điện. Khi nguyên tử nhường hay nhận electron, nó trở thành phần tử mang điện gọi là
A. ion.
B. cation.
C. anion.
D. ion dương.
Đáp án: A
Giải thích:
Nguyên tử trung hòa về điện. Khi nguyên tử nhường hay nhận electron, nó trở thành phần tử mang điện gọi là ion.
Câu 17: Liên kết ion tạo thành giữa hai nguyên tử
A. kim loại điển hình và phi kim điển hình.
B. phi kim điển hình.
C. kim loại và phi kim.
D. kim loại điển hình.
Đáp án: A
Giải thích:
Liên kết ion tạo thành giữa hai nguyên tử kim loại điển hình và phi kim điển hình.
Câu 18: Ở các nút mạng của tinh thể natri clorua là:
A. phân tử NaCl.
B. các nguyên tử và phân tử Na, Cl2.
C. các nguyên tử Na, Cl.
D. các ion Na+,Cl−.
Đáp án: D
Giải thích:
Ở các nút mạng của tinh thể natri clorua là các ion Na+,Cl−
Câu 19: Trong tinh thể NaCl, xung quanh mỗi ion có bao nhiêu ion ngược dấu gần nhất ?
A. 2.
B. 4.
C. 6.
D. 8.
Đáp án: C
Giải thích:
Trong tinh thể NaCl, các ion phân bố luân phiên trên các đỉnh của các hình lập phương nhỏ. Xung quanh mỗi ion có 6 ion ngược dấu gần nhất.
Câu 20: Liên kết hóa học trong phân tử NaF là :
A. Liên kết cộng hóa trị không cực.
B. Liên kết hiđro.
C. Liên kết ion.
D. Liên kết cộng hóa trị có cực.
Đáp án: C
Giải thích:
Na là kim loại điển hình, F là phi kim điển hình
→ Liên kết hóa học trong phân tử NaF là ion.
Câu 21: Cho nguyên tố clo (Z = 17). Cấu hình electron của ion Cl− là:
A. [Ne]3s23p5
B. [Ne]3s23p6
C. [Ne]3s23p4
D. [Ne]3s23p3
Đáp án: B
Giải thích:
Nguyên tố Cl có Z = 17
→ có 17 electron.
Nguyên tử clo nhận 1 electron để hình thành ion Cl−
→ Ion Cl− có 18 electron.
→ Cấu hình electron của là: [Ne]3s23p6
Câu 22: Khi tạo thành liên kết ion, nguyên tử nhường electron hóa trị để trở thành:
A. cation có nhiều proton hơn.
B. anion có nhiều proton hơn.
C. cation có số proton không thay đổi.
D. anion có số proton không thay đổi.
Đáp án: C
Giải thích:
Khi nguyên tử nhường electron hóa trị sẽ hình thành cation (ion dương) và số proton của ion không thay đổi so với nguyên tử.
Câu 23: Nguyên tố K có số hiệu nguyên tử là 19. Khi kali tham gia phản ứng tạo hợp chất ion. Cấu hình electron của ion kali là:
A. [Ne]3s23p6
B. [Ne]3s23p54s2
C. [Ne]3s23p64s1
D. [Ne]3s23p64s2
Đáp án: A
Giải thích:
Nguyên tố K có số hiệu nguyên tử là 19
→ Nguyên tử K có 19 electron.
→ Cấu hình electron của nguyên tử K là: [Ne]3s23p64s1
→ Nguyên tử K sẽ nhường 1 electron hóa trị để hình thành ion
→ Cấu hình electron của ion K+ là: [Ne]3s23p6
Câu 24: Ion nào là ion đơn nguyên tử?
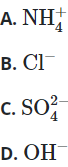
Đáp án: B
Giải thích:
Ion đơn nguyên tử là các ion được tạo nên từ một nguyên tử.
Câu 25: Nguyên tử nào dưới đây nhường 2 electron để đạt cấu trúc ion bền:
A. Mg (Z = 12)
B. F (Z = 9)
C. Na (Z = 11)
D. O (Z = 8)
Đáp án: A
Giải thích:
Nguyên tử nhường 2 electron để đạt cấu trúc ion bền vậy nguyên tử cần tìm là nguyên tử kim loại có 2 electron lớp ngoài cùng.
Cấu hình electron của các nguyên tử:
Mg: 1s22s22p63s2
F: 1s22s22p5
Na: 1s22s22p63s1
O: 1s22s22p4
→ Nguyên tử Mg sẽ nhường 2 electron để đạt cấu hình bền.
Câu 26: Cho 3 ion: 11Na+,12Mg2+,9F−. Tìm câu khẳng định sai:
A. 3 ion trên có cùng số proton.
B. 3 ion trên có số electron lớp ngoài cùng bằng nhau.
C. 3 ion trên có cùng số electron.
D. 3 ion trên có cấu hình electron giống nhau.
Đáp án: A
Giải thích:
Các hình electron của các ion:
F-: 1s22s22p6
Na+: 1s22s22p6
Mg2+: 1s22s22p6
→ Các ion này đều có cùng cấu hình electron, số electron lớp ngoài cùng đều là 8 electron.
→ A sai. Vì 3 ion 1Na+,12Mg2+,9F− có số proton lần lượt là: 11, 12 và 9.
Câu 27: Phương trình biểu diễn sự hình thành ion nào sau đây không đúng?
A. Na → Na+ + 1e
B. Cl + 1e → Cl-
C. K → K+ + 1e
D. Al + 3e → Al3+
Đáp án: D
Giải thích:
D sai. Al + 3e → Al3+
Câu 28: Phát biểu nào sai khi nói về liên kết ion ?
A. Được hình thành bởi các cặp electron chung.
B. Hợp chất ion thường tan tốt trong nước.
C. Được hình thành bởi lực hút tĩnh điện từ các ion trái dấu.
D. Hợp chất ion thường được hình thành giữa kim loại điển hình và phi kim điển hình.
Đáp án: A
Giải thích:
Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu không phải các cặp electron chung.
Câu 29: Oxi ở ô thứ 8 trong bảng tuần hoàn, oxi dễ dàng:
A. Nhường 6 electron để hình thành ion.
B. Nhường 6 electron để hình thành ion.
C. Nhường 2 electron để hình thành ion.
D. Nhận 2 electron để hình thành ion.
Đáp án: D
Giải thích:
Oxi ở ô thứ 8 trong bảng tuần hoàn
→ Oxi có 8 electron.
→ Cấu hình electron của nguyên tử oxi: 1s22s22p4
→ Lớp ngoài cùng của O đang có 6 electron
→ Oxi có xu hướng nhận thêm 2 electron để đạt cấu hình bền của khí hiếm gần nó nhất.
→ Cấu hình của của ion O2− là: 1s22s22p6
Câu 30: Cho các ion:
K+, Na+, Mg2+, Al3+, Ca2+, O2−, Cl− a Số ion có 18 electron là:
A. 2
B. 3
C. 4
D. 5
Đáp án: B
Giải thích:
Cấu hình electron của các ion là:
K+:1s22s2263s23p6
Na+:1s22s22p6
Mg2+:1s22s22p6
Al3+:1s22s22p6
Ca2+:1s22s22p63s23p6
O2−:1s22s22p6
Cl−:1s22s22p63s23p6
→ Các ion có 18 electron: K+, Ca2+, Cl−
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hóa khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.