Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Liên kết cộng hóa trị Chân trời sáng tạo (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Liên kết cộng hóa trị Chân trời sáng tạo (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Sự tạo thành liên kết cộng hóa trị
Nguyên tử phi kim có xu hướng nhận thêm electron để đạt cấu hình electron bền vững của khí hiếm.
Khi hai nguyên tử phi kim kết hợp với nhau tạo thành phân tử, chúng sẽ góp chung một hoặc nhiều electron để tạo thành các cặp electron dùng chung. Các cặp electron dùng chung được tính cho cả hai nguyên tử trong phân tử nên mỗi nguyên tử đều đạt cấu hình bền vững theo quy tắc octet. Cặp electron dùng chung tạo ra liên kết cộng hóa trị giữa hai nguyên tử.
Cặp electron dùng chung giữa hai nguyên tử có thể được tạo thành theo hai kiểu khác nhau:
- Mỗi nguyên tử góp một hay nhiều electron để tạo thành các cặp electron dùng chung:
Ví dụ:
A× + ×B → A : B hoặc A – B (liên kết A – B là liên kết cộng hóa trị).
- Cặp electron dùng chung chỉ do một nguyên tử đóng góp, liên kết giữa hai nguyên tử là liên kết cộng hóa trị kiểu cho – nhận.
Ví dụ:
Khi cặp electron dùng chung chỉ do nguyên tử B đóng góp, nguyên tử B là nguyên tử cho electron, nguyên tử A là nguyên tử nhận electron. Kí hiệu B → A.
1. Sự tạo thành phân tử có liên kết đơn
- Phân tử chlorine (Cl2):
Cấu hình electron của nguyên tử Cl (Z = 17): [Ne]3s23p5 (có 7 electron hóa trị).
Hai nguyên tử chlorine liên kết với nhau bằng cách mỗi nguyên tử chlorine góp 1 electron, tạo thành 1 cặp electron dùng chung. Khi đó, trong phân tử Cl2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet
Từ công thức electron, thay một cặp electron dùng chung bằng một gạch nối thì thu được công thức Lewis (Li-uýt).
Giữa hai nguyên tử chlorine có một cặp electron dùng chung (biểu diễn bằng một gạch nối), đó là liên kết đơn.
- Phân tử hydrogen chloride (HCl):
Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl. Khi đó nguyên tử hydrogen có 2 electron (cấu hình bền vững của nguyên tử khí hiếm helium) và nguyên tử chlorine có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
Giữa hai nguyên tử hydrogen và chlorine có một cặp electron dùng chung (biểu diễn bằng 1 gạch nối), đó là liên kết đơn.
- Phân tử hợp chất có liên kết cho – nhận:
Trong phân tử NH3, lớp ngoài cùng của nguyên tử nitrogen có 5 electron, trong đó có cặp electron chưa liên kết. Ion H+ có orbital trống, không có electron. Khi phân tử NH3 kết hợp với ion H+, nguyên tử nitrogen đóng góp cặp electron chưa liên kết để tạo liên kết với ion H+ tạo thành. Khi đó, liên kết cho – nhận được hình thành, nguyên tử nitrogen là nguyên tử cho, ion H+ là nguyên tử nhận. Trong ion , bốn liên kết N – H hoàn toàn tương đương nhau.
2. Sự tạo thành phân tử có liên kết đôi
- Phân tử oxygen (O2):
Mỗi nguyên tử oxygen có 6 electron hóa trị, hai nguyên tử oxygen liên kết với nhau bằng cách mỗi nguyên tử đóng góp 2 electron, tạo thành 2 cặp electron dùng chung. Trong phân tử O2, mỗi nguyên tử oxygen đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
Giữa hai nguyên tử oxygen có hai cặp electron dùng chung (biểu diễn bằng hai gạch nối), đó là liên kết đôi.
- Phân tử carbon dioxide (CO2):
Nguyên tử carbon có 4 electron hóa trị, nguyên tử oxygen có 6 electron hóa trị. Hai nguyên tử oxygen liên kết với một nguyên tử carbon bằng cách mỗi nguyên tử oxygen đóng góp 2 electron và nguyên tử carbon đóng góp 4 electron tạo thành 4 cặp electron dùng chung. Khi đó, trong phân tử CO2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
Phân tử CO2 có hai liên kết đôi.
3. Sự tạo thành phân tử có liên kết ba
Phân tử nitrogen (N2):
Nguyên tử nitrogen có 5 electron hóa trị, hai nguyên tử nitrogen liên kết với nhau bằng cách mỗi nguyên tử nitrogen đóng góp 3 electron, tạo thành 3 cặp electron dùng chung. Khi đó, trong phân tử N2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
Giữa hai nguyên tử nitrogen có ba cặp electron dùng chung (biểu diễn bằng ba gạch nối), đó là liên kết ba.
Kết luận:
- Liên kết cộng hóa trị là liên kết được tạo thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
- Liên kết trong các phân tử Cl2, O2, N2, … có cặp electron dùng chung không bị hút lệch về phía nguyên tử nào được gọi là liên kết cộng hóa trị không phân cực.
- Liên kết trong phân tử HCl có cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn (Cl) được gọi là liên kết cộng hóa trị phân cực.
II. Độ âm điện và liên kết hóa học
Dựa vào sự khác nhau về độ âm điện giữa các nguyên tử tham gia liên kết, có thể dự đoán được loại liên kết giữa hai nguyên tử đó.
Ví dụ:
- Trong phân tử HCl, hiệu độ âm điện của Cl và H: 3,16 – 2,20 = 0,96.
Liên kết giữa H và Cl là liên kết cộng hóa trị phân cực.
- Trong phân tử CO2, hiệu độ âm điện của O và C: 3,44 – 2,55 = 0,89.
Liên kết giữa C và O là liên kết cộng hóa trị phân cực. Tuy nhiên, do phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết đôi (C=O) triệt tiêu nhau, dẫn đến toàn bộ phân tử không bị phân cực.
- Trong phân tử NaCl, hiệu độ âm điện của Cl và Na: 3,16 – 0,93 = 2,23.
Liên kết giữa Na và Cl là liên kết ion.
Chú ý:
Liên kết cộng hóa trị phân cực có thể được coi là dạng trung gian giữa liên kết công hóa trị không phân cực và liên kết ion.
III. Mô tả liên kết cộng hóa trị bằng sự xen phủ các orbital nguyên tử
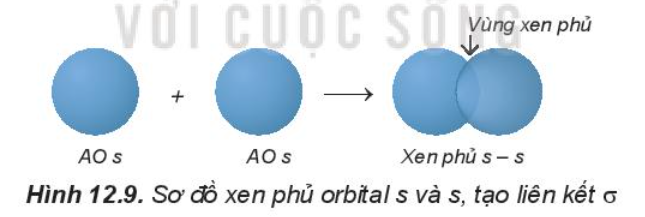
1. Sự xen phủ các orbital nguyên tử tạo liên kết s (sigma)
- Sự xen phủ s – s:
Phân tử H2 tạo thành từ hai nguyên tử H (1s1). Khi 2 nguyên tử H tiến lại gần nhau, hạt nhân của nguyên tử này hút đám mây electron của nguyên tử kia, hai orbital nguyên tử xen phủ vào nhau một phần. Vùng xen phủ có mật độ điện tích âm lớn, làm tăng lực hút của mỗi hạt nhân với vùng này và làm cân bằng lực đẩy giữa hai hạt nhân, để hai nguyên tử liên kết với nhau.
- Sự xen phủ s – p:
Phân tử HF tạo thành khi orbital 1s của nguyên tử H (1s1) xen phủ với orbital 2p của nguyên tử F (2s22p5) theo trục liên kết, tạo liên kết cộng hóa trị giữa H và F, vùng xen phủ càng lớn thì liên kết càng bền.
- Sự xen phủ p – p:
Phân tử Cl2 tạo thành khi hai orbital 3p của hai nguyên tử Cl (3s23p5) xen phủ theo trục liên kết của hai nguyên tử Cl.
Nhận xét:
Các liên kết cộng hóa trị đơn đều là liên kết s. Trong liên kết s, mật độ xác suất tìm thấy electron lớn nhất dọc theo trục liên kết.
2. Sự xen phủ các orbital nguyên tử tạo liên kết p (pi)
Sự xen phủ, trong đó trục của các orbital tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết, được gọi là xen phủ bên. Sự xen phủ bên tạo ra liên kết p (pi).
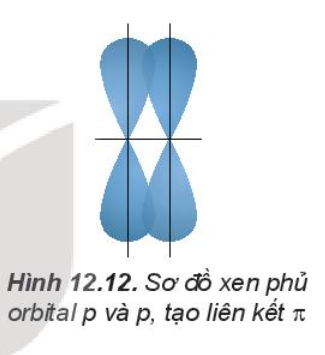
Liên kết đôi gồm một liên kết s và một liên kết p. Liên kết ba gồm một liên kết s và hai liên kết p.
IV. Năng lượng liên kết cộng hóa trị
Năng lượng liên kết (Eb) là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử ở thể khí thành các nguyên tử ở thể khí. Năng lượng liên kết thường có đơn vị là kJ/mol.
Ví dụ: Để phá vỡ 1 mol liên kết H–Cl thành các nguyên tử H và Cl (ở thể khí) theo phương trình:
HCl(g) H(g) + Cl(g)
cần năng lượng là 432 kJ, nên năng lượng liên kết H–Cl là Eb = 432 kJ/mol.
Năng lượng liên kết đặc trưng cho độ bền của liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền và phân tử càng khó bị phân hủy.
Bài tập
Câu 1. Liên kết cộng hóa trị là liên kết được hình thành bởi
A. lực hút tĩnh điện giữa các ion trái dấu.
B. một hay nhiều cặp electron chung giữa hai nguyên tử.
C. lực hút tĩnh điện giữa các ion cùng dấu.
D. sự cho và nhận electron giữa hai nguyên tử.
Đáp án: B
Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
Câu 2. Liên kết giữa nguyên tử H và F trong phân tử HF được tạo nên bởi
A. 1 cặp electron chung.
B. 2 cặp electron chung.
C. 3 cặp electron chung.
D. 4 cặp electron chung.
Đáp án: A
Nguyên tử H có cấu hình electron là 1s1; nguyên tử Cl có cấu hình electron là 1s22s22p5. Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và F cùng góp 1 electron để tạo nên 1 cặp electron chung.
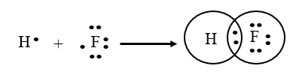
→ Công thức cấu tạo của HF là: H – F.
Câu 3. Công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng gọi là
A. công thức cộng hóa trị.
B. công thức electron.
C. công thức Lewis.
D. công thức ion.
Đáp án: C
Công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng.
Câu 4. Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn
A. bằng một mũi tên (→) và goi là liên kết đơn.
B. bằng một nối ba (≡≡) và goi là liên kết ba.
C. bằng một nối đôi (=) và goi là liên kết đôi.
D. bằng một nối đơn (–) và goi là liên kết đơn.
Đáp án: D
Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn bằng một nối đơn (–) và gọi là liên kết đơn.
Nếu giữa hai nguyên tử có hai cặp electron chung thì hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
Nếu giữa hai nguyên tử có ba cặp electron chung thì ba cặp electron này được biểu diễn bằng một nối ba (≡≡) và gọi là liên kết ba.
Câu 5. Công thức cấu tạo của CO2 là
A. O-C-O.
B. C-O-O.
C. O=C=O.
D. O=C-O.
Đáp án: C
Cấu hình electron nguyên tử của C (Z = 6): 1s22s22p2.
Cấu hình electron của nguyên tử O (Z = 8): 1s22s22p4.
Nguyên tử C cần thêm 4 electron để đạt được cấu hình bền vững của khí hiếm gần nhất; nguyên tử O cần 2 electron để đạt được cấu hình của khí hiếm gần nhất.
→ Mỗi nguyên tử O góp chung 2 electron, nguyên tử C góp chung 4 electron chia đều cho 2 nguyên tử O.
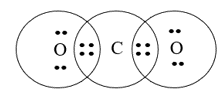
→ Công thức cấu tạo của CO2 là O=C=O.
Câu 6. Liên kết giữa 2 nguyên tử N trong phân tử N2 là
A. liên kết đôi.
B. liên kết ba.
C. liên kết đơn.
D. liên kết ion.
Đáp án: B
Cấu hình electron của nguyên tử N (Z = 7): 1s22s22p3.
Nguyên tử N có 5 electron lớp ngoài cùng.
Mỗi nguyên tử N cần 3 electron để đạt được cấu hình electron của khí hiếm gần nhất. Do đó, mỗi nguyên tử N góp chung 3 electron.
→ Công thức cấu tạo của N2 là N≡≡N.
→ Liên kết giữa 2 nguyên tử N trong phân tử N2 là liên kết ba.
Câu 7. Liên kết mà cặp electron chung được đóng góp từ một nguyên tử được gọi là
A. liên kết ion.
B. liên kết hiđro.
C. liên kết cộng hóa trị có cực.
D. liên kết cho – nhận.
Đáp án: D
Liên kết mà cặp electron chung được đóng góp từ một nguyên tử được gọi là liên kết cho – nhận.
Câu 8. Trong phân tử nào đây có chứa liên kết cho nhận?
A. HCl.
B. O2.
C. NaCl.
D. SO2.
Đáp án: D
Trong phân tử SO2 có liên kết cho – nhận.
Giải thích:
Cấu hình electron của nguyên tử S (Z = 16): [Ne]3s23p4.
Cấu hình electron của nguyên tử O (Z = 8); 1s22s22p4.
Nguyên tử S có 6 electron ở lớp ngoài cùng. Khi hình thành phân tử SO2, nguyên tử S đã dùng 2 electron độc thân góp chung với 2 electron độc thân của một trong hai nguyên tử O. Nguyên tử S sử dụng một cặp electron để dùng chung với nguyên tử O còn lại.
→ Công thức cấu tạo của SO2:
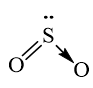
(Liên kết cho – nhận được biểu diễn bằng mũi tên →)
Loại A, vì: Liên kết trong phân tử HCl là liên kết cộng hóa trị có cực.
Loại B, vì: Liên kết trong phân tử O2 là liên kết cộng hóa trị không cực.
Loại C, vì: Liên kết trong phân tử NaCl là liên kết ion.
Câu 9. Nguyên tử A và B có độ âm điện lần lượt là χ(A) , χ(B) (χ(B) ≥ χ(A) ). Hiệu độ âm điện giữa hai nguyên tử A, B là Δχ = χ(B) - χ(A). Nếu liên kết giữa hai nguyên tử A và B là liên kết cộng hóa trị có cực thì
A. 0 ≤ Δχ < 0,4.
B. 0,4 ≤ Δχ < 1,7.
C. Δχ ≥ 1,7.
D. 1,7 ≤ Δχ < 4,0.
Đáp án: B
Sự khác biệt về hiệu độ âm điện (Δχ) giữa hai nguyên tử A và B có thể biểu diễn kiểu liên kết giữa hai nguyên tử đó.
0 ≤ Δχ < 0,4: Liên kết cộng hóa trị không cực.
0,4 ≤ Δχ < 1,7: Liên kết cộng hóa trị có cực.
Δχ ≥ 1,7: Liên kết ion.
Câu 10. Liên kết giữa hai nguyên tử Cl trong phân tử Cl2 là
A. liên kết cộng hóa trị không cực.
B. liên kết cộng hóa trị có cực.
C. liên kết ion.
D. liên kết cho – nhận.
Đáp án: A
Δχ = 0 nên liên kết giữa hai nguyên tử Cl là liên kết cộng hóa trị không cực.
Câu 11. Cho biết độ âm điện của nguyên tử H và Cl lần lượt là 2,2 và 3,2. Liên kết giữa nguyên tử H và Cl trong phân tử HCl là
A. liên kết ion.
B. liên kết cộng hóa trị không cực.
C. liên kết cộng hóa trị có cực.
D. liên kết cho – nhận.
Đáp án: C
Δχ = χ(Cl) - χ(H) = 3,2 – 2,2 = 1,0.
Nhận xét: 0,4 ≤ Δχ < 1,7 → liên kết giữa nguyên tử H và Cl là liên kết cộng hóa trị có cực (cặp electron chung bị lệch về phía nguyên tử Cl).
Câu 12. Liên kết ba gồm
A. 3 liên kết s.
B. 1 liên kết s và 2 liên kết p.
C. 2 liên kết s và 1 liên kết p.
D. 1 liên kết s và 1 liên kết p.
Đáp án: B
Liên kết đơn còn gọi là liên kết s, liên kết đôi gồm 1 liên kết s và 1 liên kết p, liên kết ba gồm 1 liên kết s và 2 liên kết p.
Câu 13. Cho các phát biểu sau:
(1) Trong phân tử HCl, cặp electron chung bị lệch về phía nguyên tử H.
(2) Liên kết s kém bền hơn liên kết p.
(3) Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma (s).
(4) Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi (p).
Trong các phát biểu trên, số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: B
Phát biểu đúng: (3), (4).
Phát biểu (1) không đúng, vì: Trong phân tử HCl, cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn là Cl.
Phát biểu (2) không đúng, vì: Liên kết s bền hơn liên kết p bởi vùng xen phủ AO chứa electron chung chắn giữa hai hạt nhân, làm giảm lực đẩy giữa chúng.
Câu 14. Năng lượng cần thiết để phá vỡ một loại liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar được gọi là
A. năng lượng nguyên tử.
B. năng lượng hạt nhân.
C. năng lượng liên kết.
D. năng lượng hóa học.
Đáp án: C
Năng lượng cần thiết để phá vỡ một loại liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar được gọi là năng lượng liên kết.
Câu 15. Cho biết năng lượng liên kết của H–F là 565 KJ mol-1; H–Cl là 431 KJ mol-1; H–Br là 364 KJ mol-1; H–I là 297 KJ mol-1. Trong các liên kết trên, liên kết nào bền nhất?
A. H–F.
B. H–Cl.
C. H–Br.
D. H–I.
Đáp án: A
Năng lượng liên kết càng lớn, liên kết đó càng bền.
→ So sánh độ bền liên kết: H–F > H–Cl > H–Br > H–I.
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hóa khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.