Với giải Câu hỏi trang 67 SGK Hoá học10 Chân trời sáng tạo trong Bài 11: Liên kết hydrogen và tương tác van der waals giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Chân trời sáng tạo trang 67 Bài 11: Liên kết hydrogen và tương tác van der waals
Mở đầu trang 67 Hóa học 10: Các nhà hóa học đã nghiên cứu và kết luận rằng nếu không có liên kết hydrogen thì nước sẽ sôi ở -80oC. Như vậy, trong điều kiện thường, nước sẽ tồn tại ở thể khí (hơi nước). Khi đó, trên Trái Đất sẽ chẳng có các đại dương, sông, hồ,… và cũng không bao giờ có mưa. Mọi sự sống sẽ không tồn tại. Trái Đất sẽ là một hành tinh chết nếu không có sự hiện của liên kết hydrogen. Liên kết hydrogen giữa các phân tử nước được tạo thành như thế nào? Ảnh hưởng của liên kết hydrogen với tính chất vật lí của nước ra sao?

Lời giải:
Liên kết hydrogen giữa các phân tử nước là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với nguyên tử O có độ âm điện lớn) của phân tử nước này với một nguyên tử O (còn cặp electron hóa trị chưa tham gia liên kết) của phân tử nước khác.
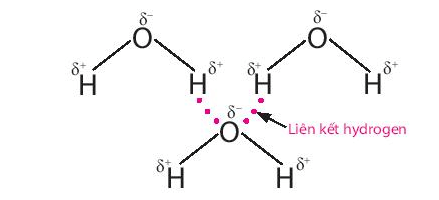
Nhờ có liên kết hydrogen mà ở điều kiện thường nước ở thể lỏng, có nhiệt độ sôi cao (100oC).
1. Liên kết Hydrogen
Lời giải:
- Độ âm điện của O bằng 3,44; của H bằng 2,2 ⇒ Liên kết O-H là liên kết cộng hóa trị phân cực
- Độ âm điện của S bằng 2,58; của H bằng 2,2 do đó liên kết S-H là liên kết cộng hóa trị không phân cực.
Vậy liên kết O-H phân cực mạnh hơn.
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 67 Hóa học 10: Các nhà hóa học đã nghiên cứu và kết luận rằng nếu không có liên kết hydrogen thì nước sẽ sôi ở -80oC...
Luyện tập trang 68 Hóa học 10: Điều gì đã khiến H2O có nhiệt độ sôi cao hơn H2S? Giải thích...
Câu hỏi 6 trang 69 Hóa học 10: Quan sát Hình 11.7, cho biết thế nào là một lưỡng cực tạm thời?...
Vận dụng trang 70 Hóa học 10: Tại sao nhện nước có thể di chuyển trên mặt nước?...
Bài 1 trang 71 Hóa học 10: Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử...
Bài 3 trang 71 Hóa học 10: Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?...
Bài 4 trang 71 Hóa học 10: Biểu diễn liên kết hydrogen giữa các phân tử...
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 12: Phản ứng oxi hoá - khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.