Với giải Câu hỏi trang 56 SGK Hoá học10 Cánh Diều Bài 10: Liên kết ion giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Cánh Diều trang 56 Bài 10: Liên kết ion
(a) cộng hóa trị.
(b) ion.
(c) có công thức Al2O3
(d) có công thức Al3O2
Lời giải:
Đáp án đúng là: (b) ion.
Hai ion Al3+ và O2- trái dấu hút nhau bằng lực hút tĩnh điện tạo hợp chất Al2O3
2Al3+ + 3O2- → Al2O3
⇒ Hợp chất tạo nên bởi ion Al3+ và O2- là hợp chất ion.
Bài 2 trang 56 Hóa học 10: Những tính chất nào sau đây là tính chất điển hình của hợp chất ion?
(a) Tồn tại ở thể khí trong điều kiện thường.
(b) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(c) Thường tồn tại ở thể rắn trong điều kiện thường.
(d) Có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Lời giải:
Những tính chất là tính chất điển hình của hợp chất ion:
(b) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(c) Thường tồn tại ở thể rắn trong điều kiện thường.
b) Vì sao cả Na2O và MgO đều là chất rắn ở điều kiện thường?
c) Vì sao nhiệt độ nóng chảy của MgO (2 852oC) cao hơn rất nhiều so với Na2O (1 132oC)?
Lời giải:
a) Nguyên tử kim loại có 1, 2, 3 electron lớp ngoài cùng, có xu hướng nhường 1, 2, 3 electron này để đạt cấu hình bền vững giống như khí hiếm. Khi nhường electron các ion kim loại mất đi 1 lớp electron ngoài cùng. Do đó bán kính ion kim loại nhỏ hơn bán kính nguyên tử kim loại tương ứng.
- Nguyên tử Na có 3 lớp electron, 1 electron lớp ngoài cùng. Nguyên tử Na đã nhường đi 1 electron ở lớp thứ 3 để trở thành ion Na+. Khi đó ion Na+ chỉ còn 2 lớp electron
⇒ Bán kính Na+ nhỏ hơn bán kính nguyên tử Na.
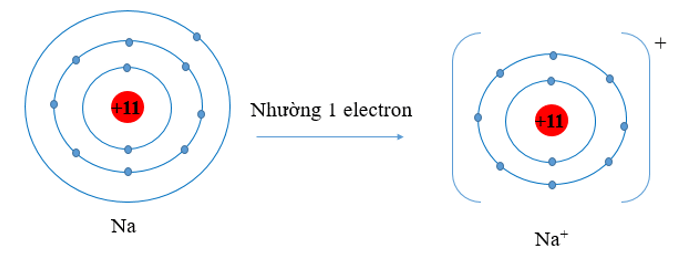
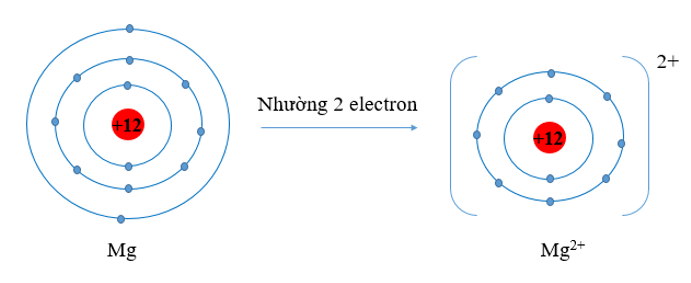
- Nguyên tử Mg có 3 lớp electron, 2 electron lớp ngoài cùng. Nguyên tử Mg đã nhường đi 2 electron ở lớp thứ 3 để trở thành ion Mg2+. Khi đó ion Mg2+ chỉ còn 2 lớp electron
⇒ Bán kính Mg2+ nhỏ hơn bán kính nguyên tử Mg2+.
b) Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion ⇒ Ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion ⇒ Ở điều kiện thường MgO tồn tại ở thể rắn.
c) Ta có:
+ Bán kính ion Na+ > bán kính ion Mg2+
+ Điện tích ion Mg2+ > điện tích ion Na+
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.
Xem thêm các bài giải Hóa học lớp 10 Cánh Diều hay, chi tiết khác:
Mở đầu trang 53 Hóa học 10: Phát biểu nào dưới đây phù hợp với sơ đồ phản ứng ở Hình 10.1?...
Câu hỏi 1 trang 53 Hóa học 10: Phát biểu nào sau đây là đúng?...
Luyện tập 1 trang 54 Hóa học 10: Hãy nêu một số hợp chất ion...
Bài 2 trang 56 Hóa học 10: Những tính chất nào sau đây là tính chất điển hình của hợp chất ion?...
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Bài 12: Liên kết hydrogen và tương tác Van Der Waals
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.