Với giải Câu hỏi trang 101 SGK Hoá học10 Cánh Diều Bài 17: Nguyên tố và đơn chất halogen giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Cánh Diều trang 101 Bài 17: Nguyên tố và đơn chất halogen
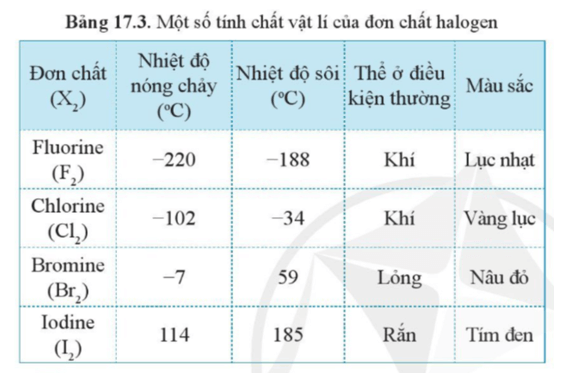
Luyện tập 1 trang 101 Hóa học 10: Dựa vào xu hướng biến đổi tính chất của các đơn chất halogen trong bảng 17.3, hãy dự đoán về thể (trạng thái) của đơn chất astatine ở điều kiện thường. Giải thích.
Lời giải:
Khi phân tử halogen có kích thước càng lớn và càng nhiều electron thì mức độ chuyển động hỗn loạn của các electron càng cao. Vì vậy thường xuyên có sự phân bố không đồng đều các electron tại một thời điểm nào đó, dễ làm xuất hiện các lưỡng cực tạm thời ở mỗi phân tử. Điều này sẽ làm tăng tương tác van der Waals giữa các phân tử halogen với nhau hay nói cách khác các phân tử halogen tương tác với nhau chặt chẽ hơn.
Trong nhóm VIIA, theo chiều tăng dần điện tích hạt nhân nguyên tử, khối lượng nguyên tử có xu hướng tăng ⇒ Khối lượng phân tử halogen X2 có xu hướng tăng ⇒ Sự tương tác giữa các phân tử trong mỗi halogen X2 tăng.
Dựa vào bảng 17.3 ta có thể thấy thể của các halogen ở điều kiện thường biến đổi từ khí (fluorine, chlorine) đến lỏng (bromine) và rắn (iodide). Mà astatine có khối lượng phân tử lớn hơn iodide.
Vậy ta có thể dự đoán đơn chất astatine tồn tại ở thể rắn ở điều kiện thường.
Luyện tập 2 trang 101 Hóa học 10: Trong điều kiện thường, halogen nào ở thể rắn? Vì sao?
Lời giải:
Dựa theo xu hướng tăng khối lượng phân tử và sự tương tác giữa các phân tử.
Khi phân tử X2 có kích thước càng lớn và càng nhiều electron thì tương tác van der Waals giữa các phân tử càng mạnh. Do đó, trong các halogen, tương tác tăng từ fluorine đến iodide.
Ở điều kiện thường bắt đầu từ iodide (I) tồn tại ở thể rắn, các nguyên tố có khối lượng phân tử lớn hơn iodide (I) là astatine At, tennessine (Ts) cũng ở thể rắn
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Mở đầu trang 99 Hóa học 10: Vì sao nước chlorine được sử dụng phổ biến để khử trùng, sát khuẩn?...
Luyện tập 2 trang 101 Hóa học 10: Trong điều kiện thường, halogen nào ở thể rắn? Vì sao?...
Bài 4 trang 107 Hóa học 10: Tra cứu các giá trị năng lượng liên kết ở phụ lục 2...
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Bài 18: Hydrogen halide và hydrohalic acid
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.