Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Nguyên tố và đơn chất halogen Cánh diều (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Nguyên tố và đơn chất halogen Cánh diều (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Giới thiệu về nguyên tố nhóm VIIA
Các nguyên tố nhóm VIIA gồm:
+ Fluorine: F
+ Chlorine: Cl
+ Bromine: Br
+ Iodine: I
+ Astatine: At
+ Tennessine: Ts

- 4 nguyên tố F, Cl, Br, I tồn tại trong tự nhiên còn At và Ts là nguyên tố phóng xạ
Một số đặc điểm của các nguyên tố Halogen:
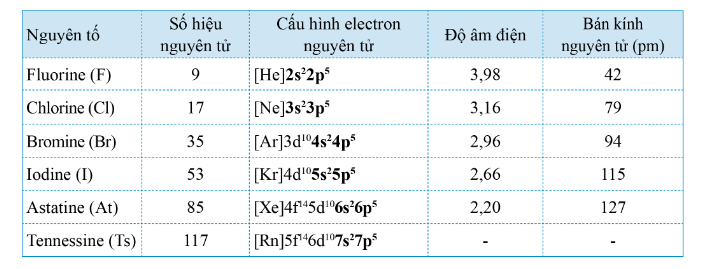
- Các nguyên tử halogen có 7 electron ở lớp ngoài cùng
=> Dễ nhận thêm 1 electron
ns2np5 + 1e → ns2np6
=> Số oxi hóa đặc trăng của halogen trong hợp chất là -1
Mỗi nguyên tử nguyên tố nhóm VIIA đều có 7 electron lớp ngoài cùng => phi kim
II. Đơn chất Halogen
Ở điều kiện thường, đơn chất Halogen tồn tại ở dạng phân tử hai nguyên tử, kí hiệu chung là X2
1. Xu hướng biến đổi một số tính chất vật lí
Một số tính chất vật lí của đơn chất Halogen:
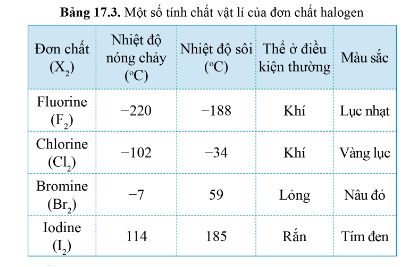
Thể của các halogen ở điều kiện thường biến đổi từ khí (fluorine, chlorine) đến lỏng (bromine) và rắn (iodine)
2. Xu hướng tạo liên kết trong các phản ứng hóa học
Nguyên tố Halogen có 7 electron hóa trị => Halogen thường có 2 xu hướng tạo liên khi phản ứng hóa học với chất khác
* Xu hướng 1: Nhận thêm 1e từ nguyên tử khác
Ví dụ: Khi chlorine phản ứng với magnesium có sự nhận và nhường electron như sau:
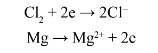
Phương trình hóa học của phản ứng là:
![]()
* Xu hướng 2: Góp chung e hóa trị với nguyên tử nguyên tố khác
Ví dụ:
Trong phản ứng giữa chlorine và hydrogen, nguyên tử của mỗi chất sẽ góp chung 1 electron độc thân để hình thành một liên kết cộng hóa trị.
![]()
Phương trình hóa học của phản ứng:
![]()
=> Nhóm Halogen có tính phi kim mạnh hơn các nhóm phi kim còn lại trong Bảng tuần hoàn
Hóa trị phổ biến của các Halogen là 1
3. Xu hướng thể hiện tính oxi hóa
a) Phản ứng với hydrogen
Các đơn chất halogen đều phản ứng với hydrogen tạo hydrogen halide nhưng ở các điều kiện phản ứng khác nhau

b) Phản ứng thế Halogen
Trong dung dịch, các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn.
c) Phản ứng với nước, với dung dịch sodium hydroxide
Các halogen(trừ fluorine) tác dụng được với nước hoặc dung dịch sodium hydroxide thể hiện cả tính oxi hóa và khử.
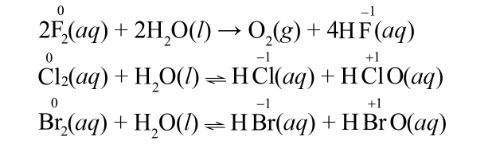
Bài tập
Câu 1. Các nguyên tố nhóm VIIA gồm
A. fluorine, chlorine, bromine, iodine và hai nguyên tố phóng xạ astatine, tennessine
B. sulfur, chlorine, bromine, indium và hai nguyên tố phóng xạ astatine, tennessine
C. fluorine, chlorine, boron, iodine và hai nguyên tố phóng xạ astatine, tennessine
D. fluorine, calcium, boron, iodine và hai nguyên tố phóng xạ astatine, tennessine
Đáp án: A
Giải thích:
Các nguyên tố nhóm VIIA gồm: fluorine (F), chlorine (Cl), bromine (Br), iodine (I) và hai nguyên tố phóng xạ astatine (At), tennessine (Ts).
Câu 2. Cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố nhóm halogen có dạng
A. ns1
B. ns2np1
C. ns2np6
D. ns2np5
Đáp án: D
Giải thích:
Các nguyên tố nhóm halogen thuộc nhóm VIIA trong bảng tuần hoàn, đều có 7 electron lớp ngoài cùng.
Cấu hình electron lớp ngoài cùng có dạng: ns2np5.
Câu 3. Trong tự nhiên, nguyên tố Cl có tồn tại trong
A. quặng fluorite
B. quặng cryolite
C. quặng fluorapatite
D. khoáng vật carnallite
Đáp án: D
Giải thích:
Quặng fluorite (CaF2); quặng cryolite (Na3AlF6); quặng fluorapatite (Ca5F(PO4)3); khoáng vật carnallite (KCl.MgCl2.6H2O)
⇒ nguyên tố Cl có tồn tại trong khoáng vật carnallite.
Câu 4. Đơn chất halogen ở trạng thái khí trong điều kiện thường, màu lục nhạt là
A. F2
B. Cl2
C. Br2
D. I2
Đáp án: A
Giải thích:
Đơn chất halogen ở trạng thái khí trong điều kiện thường, màu lục nhạt là F2.
Câu 5. Trong điều kiện thường, halogen tồn tại ở thể rắn là
A. F2
B. Cl2
C. Br2
D. I2
Đáp án: D
Giải thích:
Trong điều kiện thường, I2 tồn tại ở thể rắn.
Câu 6. Khẳng định nào sau đây sai?
A. Xu hướng tạo liên kết khi phản ứng của nguyên tử các nguyên tố halogen là: nhận thêm một electron từ nguyên tử khác.
B. Xu hướng tạo liên kết khi phản ứng của nguyên tử các nguyên tố halogen là: góp chung electron hóa trị với nguyên tử khác
C. Hóa trị phổ biến của các halogen là II
D. Nhóm halogen có tính phi kim mạnh hơn các nhóm phi kim còn lại trong bảng tuần hoàn
Đáp án: C
Giải thích:
Hóa trị phổ biến của các halogen là II ⇒ sai. Vì hóa trị phổ biến của các halogen là I.
Câu 7. Đơn chất halogen có tính oxi hóa mạnh nhất là
A. F2
B. Cl2
C. Br2
D. I2
Đáp án: A
Giải thích:
Đơn chất halogen đều có tính oxi hóa mạnh và tính oxi hóa giảm dần từ F2 đến I2.
⇒ Đơn chất halogen có tính oxi hóa mạnh nhất là F2.
Câu 8. Đi từ F2 đến I2, khẳng định sai là
A. Nhiệt độ nóng chảy tăng dần
B. Nhiệt dộ sôi tăng dần
C. Màu sắc có xu hướng nhạt dần
D. Khối lượng phân tử tăng dần
Đáp án: C
Giải thích:
F2 màu lục nhạt, Cl2 màu vàng lục, Br2 mà nâu đỏ, I2 màu tím đen.
⇒ Đi từ F2 đến I2 màu sắc có xu hướng đậm dần.
Câu 9. Đơn chất halogen chỉ thể hiện tính oxi hóa, không thể hiện tính khử là
A. I2
B. Cl2
C. F2
D. Br2
Đáp án: C
Giải thích:
Đơn chất halogen chỉ thể hiện tính oxi hóa, không thể hiện tính khử là F2.
Các halogen còn lại thể hiện cả tính oxi hóa và tính khử trong các phản ứng hóa học. Tuy nhiên xu hướng thể hiện tính oxi hóa phổ biến hơn rất nhiều và trở nên đặc trưng hơn so với xu hướng thể hiện tính khử.
Câu 10. Phản ứng diễn ra mãnh liệt, nổ ngay cả trong bóng tối hoặc ở nhiệt độ thấp là
A. H2 (g) + F2 (g) ⟶ 2HF (g)
B. H2 (g) + I2 (g) ⇆ 2HI (g)
C. H2 (g) + Cl2 (g) ⟶ 2HCl (g)
D. H2 (g) + Br2 (g) ⟶ 2HBr (g)
Đáp án: A
Giải thích:
Phản ứng diễn ra mãnh liệt, nổ ngay cả trong bóng tối hoặc ở nhiệt độ thấp là:
H2 (g) + F2 (g) ⟶ 2HF (g)
Câu 11. Cho nước chlorine màu vàng rất nhạt vào dung dịch sodium bromide không màu thì hiện tượng xảy ra là
A. Không hiện tượng
B. Xuất hiện khí màu nâu đỏ
C. dung dịch chuyển màu vàng nâu
D. dung dịch chuyển màu xanh
Đáp án: C
Giải thích:
Cl2 (aq) + 2NaBr (aq) ⟶ 2NaCl (aq) + Br2 (aq)
Do có sự hình thành đơn chất bromine (màu vàng nâu) làm dung dịch chuyển màu vàng nâu.
Câu 12. Cho F2 tác dụng với nước, sản phẩm của phản ứng là
A. Không phản ứng
B. HF và HFO
C. HF và O2
D. OF2 và H2
Đáp án: C
Giải thích:
F2 (aq) + 2H2O (l) ⟶ O2 (g) + 4HF (aq)
Câu 13. Khẳng định đúng là
A. Các halogen đều thể hiện tính khử và tính oxi hóa
B. Tính oxi hóa tăng dần từ F2 đến I2
C. Mức độ tác dụng với H2, H2O tăng dần từ F2 đến I2
D. Trong dung dịch, fluorine không có phản ứng thế halogen
Đáp án: D
Giải thích:
Các halogen đều thể hiện tính khử và tính oxi hóa ⇒ sai. Vì fluorine không thể hiện tính khử.
Tính oxi hóa tăng dần từ F2 đến I2 ⇒ sai. Vì tính oxi hóa giảm dần từ F2 đến I2.
Mức độ tác dụng với H2, H2O tăng dần từ F2 đến I2 ⇒ sai. Vì mức độ tác dụng với H2, H2O giảm dần từ F2 đến I2.
Trong dung dịch, fluorine không có phản ứng thế halogen ⇒ đúng. Vì trong dung dịch, fluorine ưu tiên phản ứng với nước.
Câu 14. Cho thí nghiệm: nhỏ vào ống nghiệm chứa 2 ml dung dịch sodium iodine (có sẵn vài giọt hồ tinh bột) vài giọt nước chlorine rồi lắc nhẹ. Hiện tượng xảy ra là
A. Không xảy ra hiện tượng
B. Xuất hiện chất rắn màu đen tím
C. Dung dịch chuyển màu vàng nâu
D. Dung dịch chuyển màu xanh tím
Đáp án: D
Giải thích:
Cl2 (aq) + 2NaI (aq) ⟶ 2NaCl (aq) + I2 (aq)
I2 (aq) + hồ tinh bột ⟶ dung dịch có màu xanh tím.
Câu 15. Cho phản ứng điện phân NaCl trong công nghiệp:
NaCl (aq) + H2O (l) ⟶ A (aq) + X (g) + Y (g)
Biết Y tác dụng được với dung dịch A tạo hỗn hợp chất tẩy rửa phổ biến.
X tác dụng với Y tạo hydrogen chloride.
Công thức của A, X, Y lần lượt là
A. NaClO, HCl, HClO
B. NaOH, H2, Cl2
C. NaOH, Cl2, H2
D. NaClO3, HCl, HClO
Đáp án: B
Giải thích:
Chất tẩy rửa phổ biến là nước Javen là dung dịch chứa NaCl và NaClO
Cl2 + 2NaOH ⟶ NaCl + NaClO + H2O
⇒ Hai chất tác dụng với nhau tạo thành nước Javen là NaOH và Cl2.
Theo phương trình, A ở dạng dung dịch, Y ở dạng khí ⇒ A là NaOH, Y là Cl2
Để tạo hydrogen chloride (HCl) cần Cl2 và H2.
Cl2 + H2 ![]() 2HCl
2HCl
Mà Y là Cl2 ⇒ X là H2.
⇒ phản ứng điện phân NaCl trong công nghiệp:
2NaCl (aq) + 2H2O (l) ⟶ 2NaOH (aq) + H2 (g) + Cl2 (g)
Vậy A, X, Y lần lượt là NaOH, H2, Cl2.
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Cánh diều hay, chi tiết khác:
Bài 16: Tốc độ phản ứng hóa học
Bài 18: Hydrogen halide và hydrohalic acid
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.