Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Hydrogen halide và hydrohalic acid Cánh diều (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Hydrogen halide và hydrohalic acid Cánh diều (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Hydrogen halide và hydrohalic acid
1. Hydrogen halide
Hợp chất gồm nguyên tố halogen và nguyên tố hydrogen có dạng HX, được gọi chung là hydrogen halide.
Hydrogen halide là hợp chất cộng hóa trị phân cực. Xu hướng phân cực giảm dần từ HF đến HI
Nhiệt độ sôi tăng dần từ hydrogen chloride đến hydrogen iodide

2. Hydrohalic acid
Trong dung dịch, hydrogen halide đều phân li ra ion H+ nên được gọi là hydrohalic acid (hay các acid HX)
Ví dụ: Sự phân li của hydrogen chloride trong nước
Tính acid của các dung dịch HX tăng theo dãy từ HF đến HI.
II. Ứng dụng của một số hydrogen halide
1. Ứng dụng của hydrogen fluoride
Ứng dụng phổ biến của hydrogen fluoride là sản xuất các hợp chất HCFC sử dụng trong hệ thống làm lạnh
- Dùng trong sản xuất cryolite, đóng vai trò “chất chảy” trong quá trình sản xuất nhôm từ aluminium oxit.
- Sử dụng trong các quá trình chế biến dầu mỏ, trong công nghiệp, hạt nhân,…

Bồn chứa hydrochloric acid ở một nhà máy
2. Ứng dụng của hydrogen chloride
- Sản xuất vinyl chloride cung cấp cho ngành nhựa
- Ammonium chloride để cung cấp cho ngành sản xuất phân bón
- Các chloride kim loại cung cấp cho ngành hóa chất
- Hợp chất hữu cơ chứa chlorine phục vị sản xuất dược phẩm, thuốc nhuộm.
III. Phân biệt các ion Halide X-
- Sử dụng thuốc thử: silver nitrate
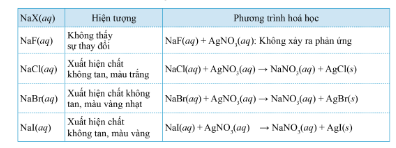

Màu sắc của các silver halide không tan
Bài tập
Câu 1. Hydrogen halide là
A. đơn chất halogen (X2)
B. hợp chất gồm nguyên tố halogen và nguyên tố hydrogen (HX)
C. hợp chất gồm nguyên tố chlorine và nguyên tố hydrogen (HCl)
D. hợp chất gồm nguyên tố halogen, nguyên tố hydrogen và nguyên tố oxygen (HXO)
Đáp án: B
Giải thích:
Hydrogen halide là hợp chất gồm nguyên tố halogen và nguyên tố hydrogen (HX).
Câu 2. Hydrogen halide là
A. đơn chất
B. hợp chất ion
C. hợp chất cộng hóa trị không cực
D. hợp chất cộng hóa trị phân cực
Đáp án: D
Giải thích:
Hydrogen halide là hợp chất cộng hóa trị phân cực do sự chênh lệch độ âm điện giữa nguyên tử H và nguyên tử halogen.
H?− : X?+
Câu 3. Xu hướng phân cực giảm từ HF đến HI là do
A. khối lượng phân tử tăng dần từ HF đến HI
B. bán kính nguyên tử halogen tăng dần từ F đến I
C. tính oxi hóa giảm dần từ F2 đến I2
D. độ âm điện giảm dần từ F đến I
Đáp án: D
Giải thích:
Xu hướng phân cực giảm từ HF đến HI là do độ âm điện giảm dần từ F đến I làm cho sự chênh lệch độ âm điện giữa H và halogen giảm dần ⇒ Độ phân cực H – X giảm dần từ HF đến HI.
Câu 4. Phân tử nào dưới đây có nhiệt độ sôi cao bất thường?
A. HCl
B. HF
C. HI
D. HBr
Đáp án: B
Giải thích:
Trong dãy hydrogen halide, nhiệt độ sôi tăng dần từ HCl đến HI. Riêng HF có nhiệt độ sôi cao bất thường do các phân tử HF tạo liên kết hydrogen với nhau.
![]()
Câu 5. Hydrohalic acid có tính acid mạnh nhất là
A. HCl
B. HF
C. HI
D. HBr
Đáp án: C
Giải thích:
Trong dãy hydrohalic acid, tính acid tăng dần từ HF đến HI.
Vậy HI có tính acid mạnh nhất.
Câu 6. Nguyên nhân chủ yếu làm tăng độ mạnh của các acid theo dãy từ HF đến HI là do
A. sự tăng khối lượng phân tử từ HF đến HI
B. sự giảm độ phân cực của liên kết từ HF đến HI
C. sự giảm độ bền liên kết từ HF đến HI
D. sự tăng kích thước từ HF đến HI
Đáp án: C
Giải thích:
Nguyên nhân chủ yếu làm tăng độ mạnh của các acid theo dãy từ HF đến HI là do sự giảm độ bền liên kết từ HF đến HI.
Câu 7. Khi phản ứng với sulfuric acid đặc thì:
(1) Ion Cl− thể hiện tính khử.
(2) Ion Br− thể hiện tính khử và sulfur trong H2SO4 từ số oxi hóa +6 về số oxi hóa +4 trong SO2.
(3) Ion I− thể hiện tính khử và sulfur trong H2SO4 từ số oxi hóa +6 về số oxi hóa −4 trong H2S.
Khẳng định đúng là
A. (1)
B. (1), (2) và (3)
C. (2) và (3)
D. (1) và (2)
Đáp án: C
Giải thích:
Khi phản ứng với sulfuric acid đặc thì:
(1) Ion Cl− thể hiện tính khử. ⇒ sai. Vì ion Cl− không thể hiện tính khử.
(2) Ion Br− thể hiện tính khử và sulfur trong H2SO4 từ số oxi hóa +6 về số oxi hóa +4 trong SO2. ⇒ đúng.
(3) Ion I− thể hiện tính khử và sulfur trong H2SO4 từ số oxi hóa +6 về số oxi hóa −4 trong H2S. ⇒ đúng.
Câu 8. Cho phản ứng: NaCl (s) + H2SO4 (l)
Sản phẩm thu được là
A. NaHSO3 và HCl
B. NaHSO4, Cl2, S và H2O
C. NaHSO4 và HCl
D. NaHSO4, Cl2, SO2 và H2O
Đáp án: C
Giải thích:
NaCl (s) + H2SO4 (l) ![]() NaHSO4 (s) + HCl (g)
NaHSO4 (s) + HCl (g)
Câu 9. Khi cho NaBr (s) tác dụng với H2SO4 đặc, đun nóng. Hiện tượng xảy ra là
A. tạo khí có mùi hắc
B. tạo khí có mùi trứng thối
C. tạo khí có mùi hắc, hơi bay ra có màu nâu đỏ
D. Không hiện tượng
Đáp án: C
Giải thích:
2NaBr (s) + 3H2SO4 (l) ![]() 2NaHSO4 (s) + Br2 (g) + SO2 (g) + 2H2O (g)
2NaHSO4 (s) + Br2 (g) + SO2 (g) + 2H2O (g)
Phản ứng tạo ra khí SO2 có mùi hắc, hơi Br2 có màu nâu đỏ.
Câu 10. Trong các ion halide X−, ion có tính khử mạnh nhất là
A. F−
B. I−
C. Br−
D. Cl−
Đáp án: A
Giải thích:
Trong các ion halide X−, tính khử tăng từ Cl− đến I− (F− không thể hiện tính khử)
⇒ ion có tính khử mạnh nhất là I−
Câu 11. Ứng dụng nào dưới đây không phải là ứng dụng của hydrogen chloride?
A. Khắc chữ lên thủy tinh
B. Sản xuất vinyl chloride cung cấp cho ngành nhựa
C. Phục vụ sản xuất dược phẩm, thuốc nhuộm
D. Tẩy rửa gỉ sét bám trên bề mặt thép
Đáp án: A
Giải thích:
Khắc chữ lên thủy tinh là ứng dụng của hydrogen fluoride (HF) theo phản ứng:
SiO2 (s) + 4HF (aq) ⟶ SiF4 (g) + 2H2O (l)
Câu 12. Thuốc thử để nhận biết các ion halide X− là
A. nước
B. quỳ tím
C. dung dịch AgNO3
D. sung dịch Ba(OH)2
Đáp án: C
Giải thích:
Thuốc thử để nhận biết các ion halide X− là dung dịch silver nitrate AgNO3.
- Khi X− là F- thì không thấy hiện tượng xảy ra.
- Khi X- là Cl- thì xuất hiện kết tủa màu trắng silver chloride (AgCl)
- Khi X- là Br- thì xuất hiện kết tủa màu vàng nhạt sliver bromide (AgBr)
- Khi X- là I- thì xuất hiện kết tủa màu vàng silver iodide (AgI)
Câu 13. Nhỏ từ từ vài giọt dung dịch silver nitrate vào ống nghiệm chứa dung dịch hydrochloride acid, ta thấy
A. không có hiện tượng xảy ra
B. xuất hiện kết tủa trắng
C. xuất hiện kết tủa vàng nhạt
D. xuất hiện kết tủa vàng
Đáp án: B
Giải thích:
AgNO3 (aq) + HCl (aq) ⟶ AgCl (s) + NaNO3 (aq)
AgCl (s) là kết tủa có màu trắng.
Câu 14. Nếu bơm từ từ cho đến hết lượng nước trong xi lanh vào bong bóng chứa khí hydrogen chloride thì hiện tượng xảy ra là
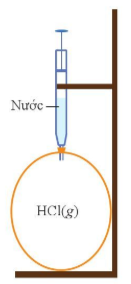
A. Bong bóng xẹp vào
B. Bong bóng phồng to hơn
C. Bong bóng đổi màu
D. Không có hiện tượng
Đáp án: A
Giải thích:
Vì khí hydrogen chloride tan nhiều trong nước tạo thành dung dịch hydrochloride acid.
⇒ Khi bơm nước vào, khí hydrogen chloride bị hòa tan hết.
⇒ Bong bóng xẹp vào.
Câu 15. Nhỏ vài giọt dung dịch silver nitrate vào ống nghiệm chứa dung dịch muối sodium halide thì thấy không có hiện tượng xảy ra. Công thức của muối đó là
A. NaCl
B. NaF
C. NaBr
D. NaI
Đáp án: B
Giải thích:
AgNO3 (aq) + NaF (aq) ⟶ Không xảy ra phản ứng.
Do đó, không có hiện tượng xảy ra.
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Cánh diều hay, chi tiết khác:
Bài 17: Nguyên tố và đơn chất halogen
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.