Với giải Câu hỏi trang 36 SBT Hoá học10 Kết nối tri thức Bài 14: Ôn tập chương 3 giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập SBT Hoá học 10. Mời các bạn đón xem:
SBT Hoá học 10 Kết nối tri thức trang 36 Bài 14: Ôn tập chương 3
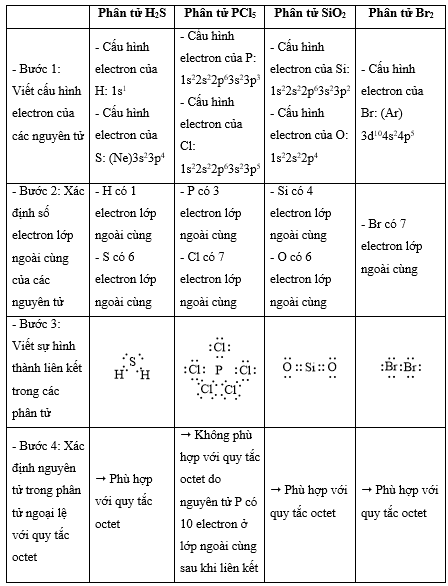
Bài 14.1 trang 36 SBT Hóa học 10: Quy tắc octet không đúng với trường hợp phân tử chất nào sau đây?
A. H2S. B. PCl5. C. SiO2. D. Br2.
Phương pháp giải:
Dựa vào
- Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium)
- Các bước thực hiện:
+ Bước 1: Viết cấu hình electron của các nguyên tử
+ Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử
+ Bước 3: Viết sự hình thành liên kết trong các phân tử
+ Bước 4: Xác định nguyên tử trong phân tử ngoại lệ với quy tắc octet
Lời giải:
Bài 14.2 trang 36 SBT Hóa học 10: Phát biểu nào sau đây không đúng về liên kết có trong phân tử HCl?
A. Giữa nguyên tử H và Cl có một liên kết đơn.
B. Các electron tham gia liên kết đồng thời bị hút về phía hai hạt nhân.
C. Phân tử có một moment lưỡng cực.
D. Một electron của nguyên tử hydrogen và một electron của nguyên tử chlorine được góp chung và cách đều hai nguyên tử.
Lời giải:
- Đáp án: D
- Giải thích: Độ âm điện của chlorine cao hơn hydrogen " cặp electron dùng chung sẽ lệch về phía nguyên tử chlorine
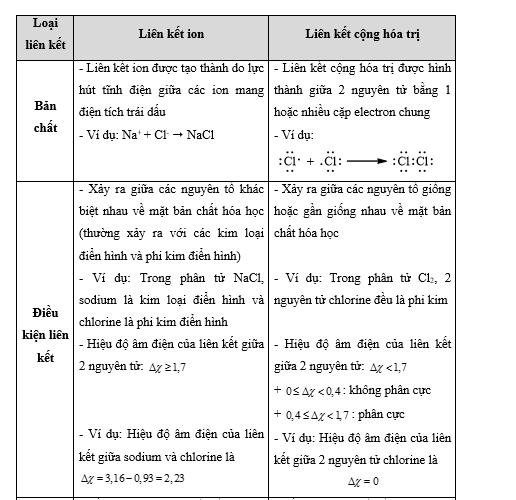
Bài 14.3 trang 36 SBT Hóa học 10: Liên kết ion khác với liên kết cộng hoá trị ở điểm nào sau đây?
A. Tính bão hoà lớp electron ở vỏ nguyên tử.
B. Tuân theo quy tắc octet.
C. Tạo ra hợp chất bền vững hơn.
D. Tính không định hướng.
Phương pháp giải:
Dựa vào sự khác nhau giữa hai loại liên kết

Lời giải:
- Đáp án: D
- Giải thích: Trong dung dịch, ion dương/ion âm có thể liên kết với 1 trong các ion âm/ion dương xung quanh
Bài 14.4 trang 36 SBT Hóa học 10: Cho chất hữu cơ A có công thức cấu tạo sau:
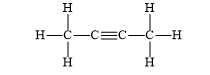
Số liên kết σ trong phần tử A là
A. 6. B. 8. C. 9. D. 11.
Phương pháp giải:
Dựa vào:
- Các liên kết cộng hóa trị đơn đều là liên kết σ
- 1 liên kết đôi gồm 1 liên kết σ và 1 liên kết π
- 1 liên kết ba gồm 1 liên kết σ và 2 liên kết π
Lời giải:
- Đáp án: C
Bài 14.5 trang 36 SBT Hóa học 10: Cho giá trị độ âm điện của một số nguyên tố sau: Na (0,93); Li (0,98), Mg (1,31); Al (1,61); P (2,19); S (2,58); Br (2,96) và C1 (3,16). Phân tử nào sau đây có liên kết ion
A. Na3P. B. MgS. C. AlCl3. D. LiBr.
Phương pháp giải:
Dựa vào hiệu độ âm điện:
|
Hiệu độ âm điện () |
Loại liên kết |
|
|
Cộng hóa trị không phân cực |
|
|
Cộng hóa trị phân cực |
|
|
Ion |
Lời giải:
|
|
Phân tử Na3P |
Phân tử MgS |
|
Hiệu độ âm điện () |
- Liên kết Na-P có = 2,19 - 0,93 = 1,26 " Liên kết cộng hóa trị phân cực |
- Liên kết Mg=S có = 2,58 - 1,31 = 1,27 " Liên kết cộng hóa trị phân cực |
|
|
Phân tử AlCl3 |
Phân tử LiBr |
|
Hiệu độ âm điện () |
- Liên kết Al-Cl có = 3,16 - 1,61 = 1,55 " Liên kết cộng hóa trị phân cực |
- Liên kết Li-Br có = 2,96 - 0,98 = 1,98 " Liên kết ion |
=> Đáp án: D
Bài 14.6 trang 36 SBT Hóa học 10: Cho hai chất hữu cơ X và Y có công thức cấu tạo sau:
Nhận xét nào sau đây là đúng?
A. X và Y có số liên kết σ và số liên kết π bằng nhau.
B. X có số liên kết σ và số liên kết π nhiều hơn Y.
C. X có số liên kết σ nhiều hơn, nhưng số liên kết π ít hơn Y.
D. X có số liên kết σ ít hơn, nhưng số liên kết π nhiều hơn Y.
Phương pháp giải:
Dựa vào:
- Các liên kết cộng hóa trị đơn đều là liên kết σ
- 1 liên kết đôi gồm 1 liên kết σ và 1 liên kết π
- 1 liên kết ba gồm 1 liên kết σ và 2 liên kết π
Lời giải:
- Đáp án: A
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 14.3 trang 36 SBT Hóa học 10: Liên kết ion khác với liên kết cộng hoá trị ở điểm nào sau đây?...
Bài 14.4 trang 36 SBT Hóa học 10: Cho chất hữu cơ A có công thức cấu tạo sau...
Bài 14.6 trang 36 SBT Hóa học 10: Cho hai chất hữu cơ X và Y có công thức cấu tạo sau...
Bài 14.10 trang 37 SBT Hóa học 10: Cho các chất sau...
Bài 14.13 trang 38 SBT Hóa học 10: Tính số liên kết σ và liên kết π trong các phân tử sau...
Bài 14.15 trang 38 SBT Hóa học 10: Cho dãy các chất kèm theo nhiệt độ sôi (°C) sau...
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.